18. 现有一定质量含有少量泥沙等不溶性杂质和少量$Na_{2}SO_{4}$、$MgCl_{2}$、$CaCl_{2}$等可溶性杂质的粗盐样品。某实验小组利用化学实验室常用仪器对该粗盐样品进行提纯,提纯步骤如下:
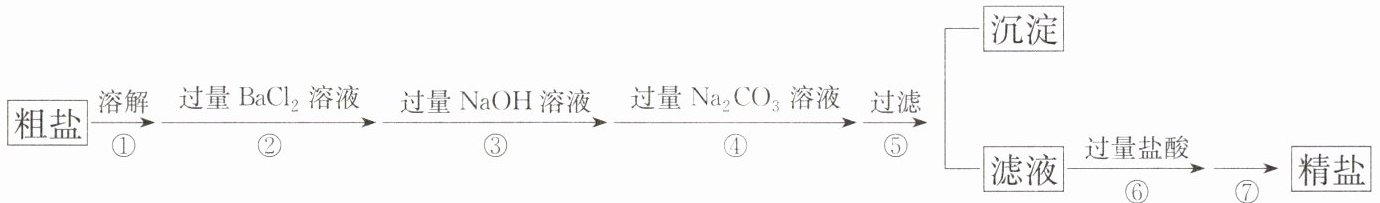
请根据提纯步骤回答下列问题。
(1)步骤⑦的操作名称为
蒸发结晶
。
(2)请写出实验步骤②中所涉及的反应的化学方程式:
$BaCl_{2}+Na_{2}SO_{4}=BaSO_{4}\downarrow+2NaCl$
。
(3)步骤⑥中加入过量盐酸的目的是
除去过量的氢氧化钠和碳酸钠
。
(4)步骤②和步骤④
不可以
(填“可以”或“不可以”)颠倒,理由是
如果颠倒,无法除去过量的氯化钡
。
(5)检验步骤④中$Na_{2}CO_{3}$溶液已过量的方法是
取上层清液于试管中,滴加氯化钙溶液,如果出现白色沉淀,说明碳酸钠溶液已经过量
。
答案:18.(1)蒸发结晶
(2)$BaCl_{2}+Na_{2}SO_{4}=BaSO_{4}\downarrow+2NaCl$
(3)除去过量的氢氧化钠和碳酸钠
(4)不可以 如果颠倒,无法除去过量的氯化钡
(5)取上层清液于试管中,滴加氯化钙溶液,如果出现白色沉淀,说明碳酸钠溶液已经过量
19. 某同学利用如图所示装置证明氢氧化钠溶液能与二氧化碳反应(装置气密性良好,实验前$K_{1}$、$K_{2}$均处于关闭状态)。
(1)打开$K_{1}$,将分液漏斗中的溶液全部注入锥形瓶内,立即关闭$K_{1}$,观察到有少量白色浑浊产生。查找原因,产生该异常现象是因为氢氧化钠饱和溶液中混入了氢氧化钙,产生白色浑浊的一个反应的化学方程式为
$Ca(OH)_{2}+CO_{2}=CaCO_{3}\downarrow+H_{2}O$或$Na_{2}CO_{3}+Ca(OH)_{2}=CaCO_{3}\downarrow+2NaOH$
。该同学分析后确认,即使所加溶液中氢氧化钙达到饱和,反应后$A$中仍无氢氧化钙剩余,说明理由:
氢氧化钙微溶于水,能和二氧化碳、碳酸钠反应
。
(2)该同学进一步分析后确定,继续实验仍可证明氢氧化钠溶液能与二氧化碳反应。为利于观察现象,打开$K_{2}$前,$A$装置需要
静置
;打开$K_{2}$,观察到的现象是
氯化钙溶液进入锥形瓶,溶液变浑浊
,该过程中多孔玻璃球泡的主要作用是
使溶液充分接触
。
(3)实验后,将$A$中物质过滤,向滤液中滴加酚酞溶液,变红。对滤液进行无害化处理,需加入的一种试剂是
稀盐酸
。

答案:19.(1)$Ca(OH)_{2}+CO_{2}=CaCO_{3}\downarrow+H_{2}O$
或$Na_{2}CO_{3}+Ca(OH)_{2}=CaCO_{3}\downarrow+2NaOH$ 氢氧化钙微溶于水,能和二氧化碳、碳酸钠反应
(2)静置 氯化钙溶液进入锥形瓶,溶液变浑浊 使溶液充分接触
(3)稀盐酸