4. 为完全中和某一强酸溶液,需用10 g 4%的${NaOH}$溶液,现改为用10 g 4%的${KOH}$溶液,反应后溶液的pH(
B
)
A.大于7
B.小于7
C.等于7
D.无法判断
答案:4.B
解析:
10g4%的NaOH溶液中含NaOH质量:$10g×4\% = 0.4g$,其物质的量:$\frac{0.4g}{40g/mol}=0.01mol$,含$OH^-$物质的量0.01mol。
10g4%的KOH溶液中含KOH质量:$10g×4\% = 0.4g$,其物质的量:$\frac{0.4g}{56g/mol}\approx0.00714mol$,含$OH^-$物质的量≈0.00714mol。
中和同一强酸,KOH提供$OH^-$少于NaOH,酸过量,反应后溶液pH<7。
B
5. 稀盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示。下列说法正确的是(
D
)
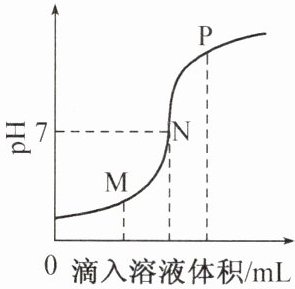
A.该反应的基本类型是中和反应
B.P点所示溶液中的溶质为${NaOH}$
C.N点所示溶液中的微粒只有${Na^{+}}$和${Cl^{-}}$
D.该图所对应操作是将${NaOH}$溶液滴入稀盐酸中
答案:5.D
6. 中和反应在工农业生产和生活中有广泛的应用。某学生课外兴趣小组对中和反应进行研究。
(1)对于没有明显实验现象产生的中和反应,如稀盐酸与稀氢氧化钠溶液的反应,要证明它们之间确实发生了化学反应,可通过如下实验来进行。
① 在盛有稀氢氧化钠溶液的烧杯中,滴加2~3滴酚酞溶液,用胶头滴管吸取稀盐酸逐滴加入上述烧杯中,边滴边用玻璃棒搅拌,当观察到
溶液由红色变为无色
现象时,说明它们之间发生了中和反应,且恰好完全反应。
② 将稀盐酸逐滴匀速加入一定量的稀氢氧化钠溶液中,用数字化仪器对反应过程中溶液的温度、pH进行实时测定,得到的曲线如图甲、乙所示。

由图甲、乙可知,稀盐酸与稀氢氧化钠溶液已发生中和反应的判断依据是
一段时间内溶液的温度升高,溶液pH明显下降直至小于7
。
(2)对于某些有明显实验现象产生的中和反应,如稀硫酸与氢氧化钡溶液的反应,只要将稀硫酸滴加到氢氧化钡溶液中,观察到
生成白色沉淀
的现象,就可说明反应已经发生。该反应的化学方程式是
$\mathrm{Ba(OH)}_2 + \mathrm{H}_2\mathrm{SO}_4 \longrightarrow \mathrm{BaSO}_4 \downarrow + 2\mathrm{H}_2\mathrm{O}$
。
答案:6.(1)①溶液由红色变为无色
②一段时间内溶液的温度升高,溶液pH明显下降直至小于7
(2)生成白色沉淀$ \mathrm{Ba(OH)}_2 + \mathrm{H}_2\mathrm{SO}_4 \longrightarrow \mathrm{BaSO}_4 \downarrow + 2\mathrm{H}_2\mathrm{O}$
7. ${HCl}$气体通入水中可得到盐酸。室温下,将${HCl}$气体通入盛有${NaOH}$溶液的试管中,直至恰好完全反应。${HCl}$气体通入${NaOH}$溶液前后,试管中溶液的离子种类如图所示,其中能使无色酚酞溶液变红的是
②
(填“①”“②”或“③”)。

答案:7.②