问题 2. 如何从微观上分析中和反应?
要点 酸和碱的中和反应,实际上是酸中的
氢离子
和碱中的
氢氧根离子
相结合,生成
水
。
应用 右图表示的是将盐酸滴入氢氧化钠溶液中,有关粒子之间反应的示意图。请回答:
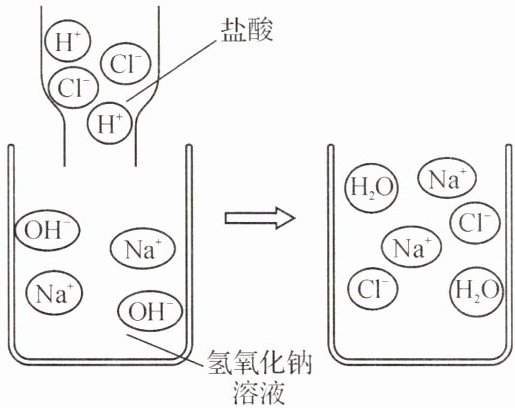
(1)该反应的化学方程式是
$\mathrm{NaOH} + \mathrm{HCl} \longrightarrow \mathrm{NaCl} + \mathrm{H}_2\mathrm{O}$
。
(2)从图中可看出该反应的微观本质是
$\mathrm{H}^+ $与$\mathrm{OH}^- $结合生成$\mathrm{H}_2\mathrm{O}$
。
(3)中和反应一定生成盐和水,那么有盐和水生成的反应一定是中和反应吗?试举例说明。
答案:问题2.要点:氢离子 氢氧根离子 水 应用:$(1)\mathrm{NaOH} + \mathrm{HCl} \longrightarrow \mathrm{NaCl} + \mathrm{H}_2\mathrm{O} $
$(2)\mathrm{H}^+ $与$\mathrm{OH}^- $结合生成$\mathrm{H}_2\mathrm{O} (3)$不一定。金属氧化物与酸反应生成盐和水(其他合理答案也可)。
1. 下列各组物质的反应,需要加入酸碱指示剂才能判断反应是否发生的是(
C
)
A.Fe 和硫酸铜溶液
B.Zn 和稀硫酸
C.氢氧化钠溶液和稀盐酸
D.澄清石灰水和二氧化碳
答案:1.C
2. 下列实际应用中,利用中和反应原理的是(
D
)
① 用氢氧化钠溶液洗涤石油产品中的残余硫酸
② 用碳酸氢钠治疗胃酸过多
③ 用熟石灰改良酸性土壤
④ 用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒
A.①②
B.②③④
C.②③
D.①③④
答案:2.D
3. 向滴有酚酞的${NaOH}$溶液中逐渐滴入稀${H_{2}SO_{4}}$至过量,下列叙述正确的是(
C
)
A.溶液由红色变为无色,pH 逐渐增大
B.溶液由无色变为红色,pH 逐渐减小
C.溶液由红色变为无色,pH 逐渐减小
D.溶液颜色不变,pH 逐渐增大
答案:3.C