问题 1. 怎样通过实验判断酸碱中和反应发生的程度?
要点 酸与碱之间会发生中和反应。酸能使紫色石蕊溶液变
红
色,不能使无色酚酞溶液变色;碱能使紫色石蕊溶液变
蓝
色,能使无色酚酞溶液变
红
色。
应用 酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
[实验探究Ⅰ] 在50 mL一定浓度的氢氧化钠溶液中滴加50 mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度
升高
,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料,小张同学发现此结论不够严谨,设计了下列三个对比实验:
① 50 mL一定浓度的盐酸与50 mL蒸馏水混合,测量溶液温度的变化。
② 50 mL一定浓度的氢氧化钠溶液与50 mL蒸馏水混合,测量溶液温度的变化。
③ 50 mL一定浓度的盐酸与50 mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化。
用数字化实验技术测得三个实验中溶液温度随时间变化的关系如图所示。
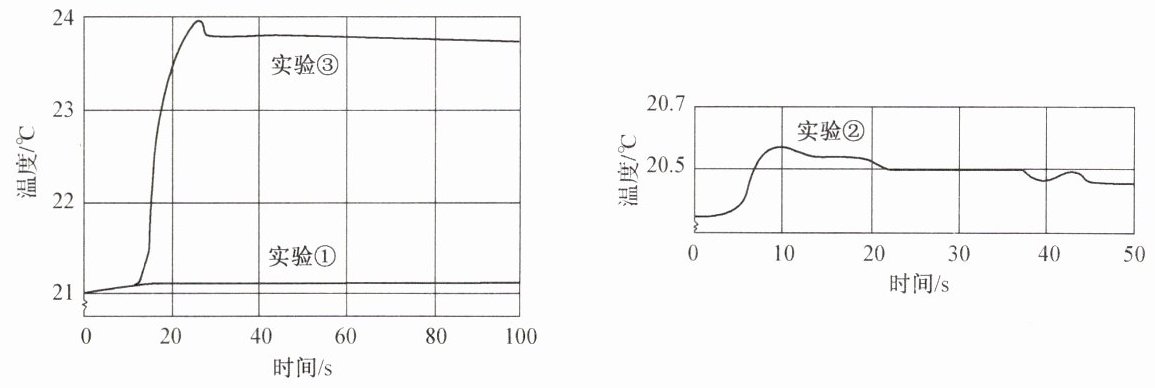
(1)由图可知,盐酸、氢氧化钠溶液分别进行稀释时均
放热
(填“放热”或“吸热”),但它们稀释时温度的变化量远
小于
(填“大于”或“小于”)两溶液混合时温度的变化量。
(2)从微观角度分析,此中和反应的温度变化主要是由于
$\mathrm{H}^+、$$\mathrm{OH}^-$
(填离子符号)两种离子发生反应放出热量的缘故。
[实验探究Ⅱ] 在50 mL一定浓度的氢氧化钠溶液中滴加2~3滴酚酞溶液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由
红色变为无色
时,可说明两者发生了反应。该反应的化学方程式为
$\mathrm{NaOH} + \mathrm{HCl} \longrightarrow \mathrm{NaCl} + \mathrm{H}_2\mathrm{O}$
。