20. 碳酸氢钠是一种重要的盐类物质,在生活中用途广泛。小滨同学设计了实验,以探究碳酸氢钠的化学性质。
[探究实验1] 碳酸氢钠溶液的酸碱性。
[实验方案]
取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞溶液,震荡,溶液变成浅红色。由此得出结论:
碳酸氢钠溶液呈碱性
。
[探究实验2] 能与酸反应。
[实验方案] 取少量该固体加入试管中,滴加稀盐酸,现象为
产生气泡
。
[探究实验3] 碳酸氢钠的热稳定性。
[实验方案]
用如图所示装置进行实验。
充分加热后,大试管口有水珠出现,管底有白色固体残留,小试管中澄清石灰水变浑浊。
[实验结论] 碳酸氢钠受热能生成二氧化碳、水和一种白色固体。
(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na₂CO₃,而不是NaOH(所选试剂不能用酸):
取少量该固体加入试管中,加适量水至完全溶解,再滴入氯化钡溶液,有白色沉淀生成
。
(2)写出碳酸氢钠受热分解的化学方程式:
2NaHCO₃$\xlongequal[ ]{ △ }$Na₂CO₃+H₂O+CO₂↑
。
[拓展应用] 试说出碳酸氢钠在日常生活中的一种用途:
治疗胃酸的药物
。

答案:20.[实验方案]碳酸氢钠溶液呈碱性
[实验方案]产生气泡
[实验结论](1)取少量该固体加入试管中,加适量水至完全溶解,再滴入氯化钡溶液,有白色沉淀生成
(2)2NaHCO₃$\xlongequal[ ]{ △ }$Na₂CO₃+H₂O+CO₂↑
[拓展应用]治疗胃酸的药物
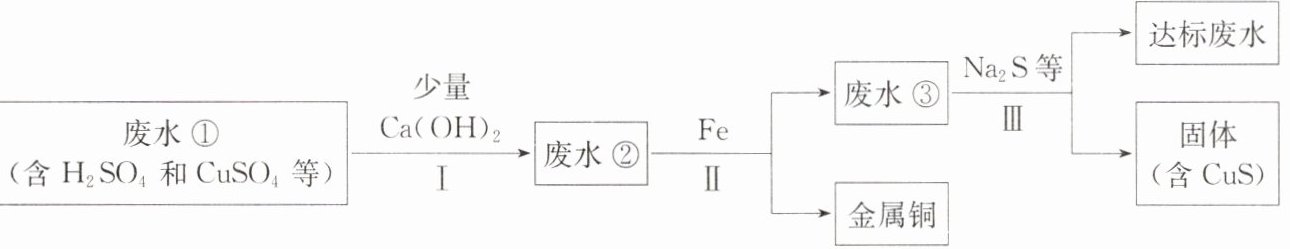
21. 矿山废水中含有大量的H₂SO₄和CuSO₄,直接排放会影响水体酸碱性,并造成重金属污染。通过处理可以回收金属铜,并使废水的pH和重金属含量达到排放标准。
已知:步骤Ⅰ无蓝色沉淀生成。
(1)步骤Ⅱ和步骤Ⅲ都需进行的操作是
过滤
。
(2)步骤Ⅱ得到金属铜的反应的化学方程式为
Fe+CuSO₄=Cu+FeSO₄
。
(3)加入Ca(OH)₂可以降低铁屑的消耗量,原因是
Ca(OH)₂会与废水中的硫酸发生反应:Ca(OH)₂+H₂SO₄=CaSO₄+2H₂O;消耗了废水中的硫酸,减少了铁屑与硫酸的反应量:Fe+H₂SO₄=FeSO₄+H₂↑
(请用文字并结合化学方程式解释)。
(4)步骤Ⅲ需加入Na₂S才能使废水达到排放标准,由此推测废水③不达标的主要原因是其中含有
CuSO₄(或Cu²⁺)
。
答案:21.(1)过滤
(2)Fe+CuSO₄=Cu+FeSO₄
(3)Ca(OH)₂会与废水中的硫酸发生反应:Ca(OH)₂+H₂SO₄=CaSO₄+2H₂O;消耗了废水中的硫酸,减少了铁屑与硫酸的反应量:Fe+H₂SO₄=FeSO₄+H₂↑ (4)CuSO₄(或Cu²⁺)