13. 综合利用海洋资源,有助于实现建设海洋强国的战略目标。
(1)浅池蒸发法以太阳能为热源,蒸发海水,获得粗盐。粗盐中的氯化钠由
离子
(填“分子”“原子”或“离子”)构成。
(2)$20 {\hspace{0pt}}^{\circ }C $时,配制$100 g$溶质质量分数为$16\%$的氯化钠溶液用于小麦选种,步骤如图所示。
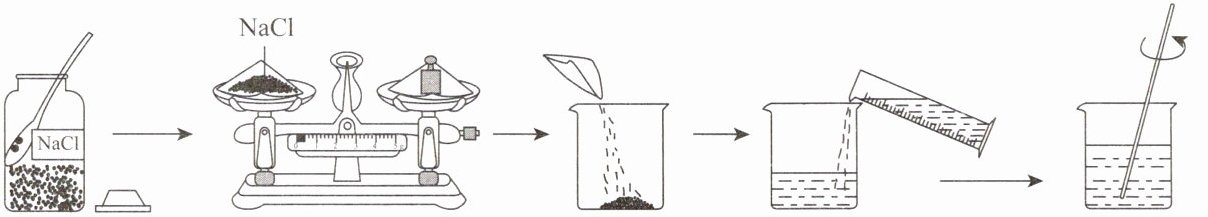
① 配制$100 g$上述溶液,需要称取氯化钠的质量为
16 g
,量取蒸馏水
84 mL
。实验中,玻璃棒的作用是
搅拌,加速溶解
。
② 已知$20 {\hspace{0pt}}^{\circ }C $时,氯化钠在水中的溶解度为$36.0 g$,则该选种液为$20 {\hspace{0pt}}^{\circ }C $时氯化钠的
不饱和
(填“饱和”或“不饱和”)溶液。
(3)选种时,将小麦种放入选种液中,劣质种子上浮,优质种子下沉。选种液的溶质质量分数越大密度越大。配制选种液,用量筒量取水时,若俯视读数,可能导致选出的优质麦种数量
减少
(填“增加”“减少”或“不变”)。
(4)用已配好的质量分数为$6\%$的氯化钠溶液(密度约为$1.04 g/cm^{3}$)配制$50 g$质量分数为$3\%$的氯化钠溶液,计算所需质量分数为$6\%$的氯化钠溶液和水的体积各多少。
答案:13. (1)离子 (2)①16 g 84 mL 搅拌,加速溶解 ②不饱和 (3)减少 (4)需要质量分数为6%的氯化钠溶液24 mL,水25 mL
解析:
(1)离子
(2)①16 g 84 mL 搅拌,加速溶解 ②不饱和
(3)减少
(4)解:设所需质量分数为6%的氯化钠溶液的质量为$x$。
$50g×3\% = x×6\%$
$x = 25g$
所需质量分数为6%的氯化钠溶液的体积为$\frac{25g}{1.04g/cm^{3}}\approx24cm^{3}=24mL$
需要水的质量为$50g - 25g = 25g$,水的体积为$\frac{25g}{1g/cm^{3}} = 25cm^{3}=25mL$
答:所需质量分数为6%的氯化钠溶液的体积为24 mL,水的体积为25 mL。
14. 下表所示是$KNO_{3}$、$NaCl$在不同温度下的溶解度。

(1)以上两种物质溶解度的变化受温度影响较小的是
NaCl
。
(2)$30 {\hspace{0pt}}^{\circ }C $时,$KNO_{3}$的溶解度是
45.8
$g$。
(3)$KNO_{3}$溶液中含有少量$NaCl$时,可通过
降温结晶(或冷却热饱和溶液)
的方法提纯。
(4)对(3)析出的晶体和剩余溶液描述正确的是
A
(填字母序号)。
A. 剩余溶液一定是$KNO_{3}$饱和溶液
B. 剩余溶液一定是$NaCl$不饱和溶液
C. 上述方法可以将两者完全分离
D. 析出的晶体中只含有$KNO_{3}$
(5)在一定温度下,将含$69 g KNO_{3}$、$18 g NaCl$的混合物完全溶解在$50 g$水中。改变温度使$KNO_{3}$析出,$NaCl$不析出,则温度$t({\hspace{0pt}}^{\circ }C )$的范围是
20 ℃≤t<70 ℃
(硝酸钾和氯化钠溶解度互不影响)。
答案:14. (1)NaCl (2)45.8
(3)降温结晶(或冷却热饱和溶液)
(4)A
(5)20 ℃≤t<70 ℃