9. 《史记正义》记载“垦畦浇晒”产盐法,过程如图所示。卤水含大量$Na_{2}SO_{4}$和$NaCl$等物质,结合溶解度曲线分析,下列说法正确的是(
C
)
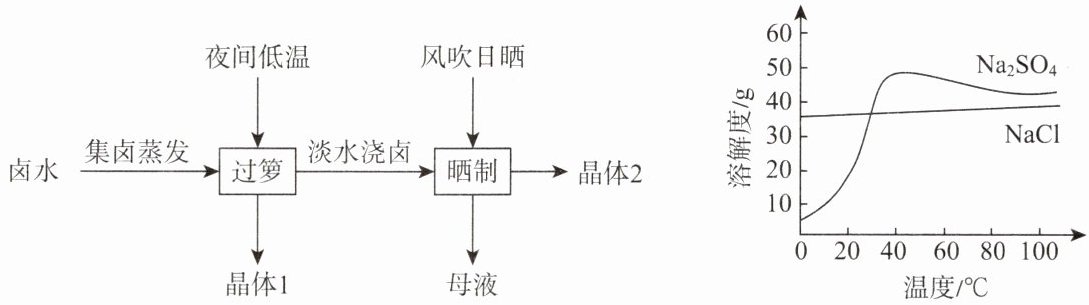
A.晶体$1$是$NaCl$,晶体$2$是$Na_{2}SO_{4}$
B.“过箩”到“晒制”,$NaCl$的质量分数一直变大
C.“母液”中含有$Na_{2}SO_{4}$和$NaCl$
D.降温结晶可除去$NaCl$溶液中的少量$Na_{2}SO_{4}$
答案:9. C
10. $KCl$与$KNO_{3}$在不同温度下的溶解度数据如表所示。下列说法正确的是(
B
)
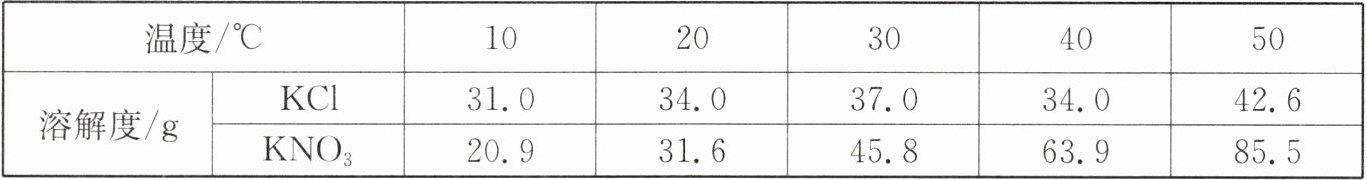
A.$KNO_{3}$比$KCl$的溶解度大
B.两物质的溶解度相等时,温度在$20 {\hspace{0pt}}^{\circ }C $与$30 {\hspace{0pt}}^{\circ }C $之间
C.在$20 {\hspace{0pt}}^{\circ }C $时,$10 g$水中加入$5 g KCl$可得到$33.3\%$的$KCl$溶液
D.在$50 {\hspace{0pt}}^{\circ }C $时,两物质各$5 g$分别加入$10 g$水中,充分溶解,均有固体剩余
答案:10. B
解析:
A. 比较溶解度需指明温度,未指明温度无法比较,A错误。
B. 20℃时,KCl溶解度34.0g,KNO₃溶解度31.6g;30℃时,KCl溶解度37.0g,KNO₃溶解度45.8g,两物质溶解度相等的温度在20℃与30℃之间,B正确。
C. 20℃时KCl溶解度34.0g,10g水最多溶解3.4g KCl,溶液溶质质量分数为$\frac{3.4g}{10g+3.4g}×100\%\approx25.4\%$,C错误。
D. 50℃时,KCl溶解度42.6g,10g水最多溶解4.26g,5g KCl加入10g水有剩余;KNO₃溶解度85.5g,10g水最多溶解8.55g,5g KNO₃加入10g水无剩余,D错误。
答案:B
11. 工业制备的重铬酸钾$(K_{2}Cr_{2}O_{7})$中常混有少量$KCl$,两种物质的溶解度曲线如图所示。下列说法正确的是(
C
)
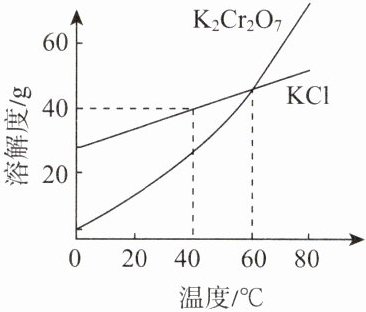
A.$K_{2}Cr_{2}O_{7}$的溶解度一定比$KCl$的大
B.$40 {\hspace{0pt}}^{\circ }C $时,将$50 g KCl$加入$100 g$水中,所得溶液质量为$150 g$
C.$60 {\hspace{0pt}}^{\circ }C $时,两种物质的饱和溶液的溶质质量分数相等
D.采用蒸发结晶的方法可除去$K_{2}Cr_{2}O_{7}$中混有的少量$KCl$
答案:11. C
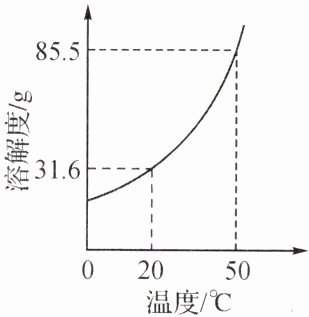
12. 在初中化学中,我们学习了溶液的有关知识。右图是$KNO_{3}$的溶解度曲线。
(1)从右图溶解度曲线可以得到的信息是
20 ℃时,KNO₃的溶解度是31.6 g
(写一条)。
(2)小明参照下图在常温$20 {\hspace{0pt}}^{\circ }C $时进行了如下实验:
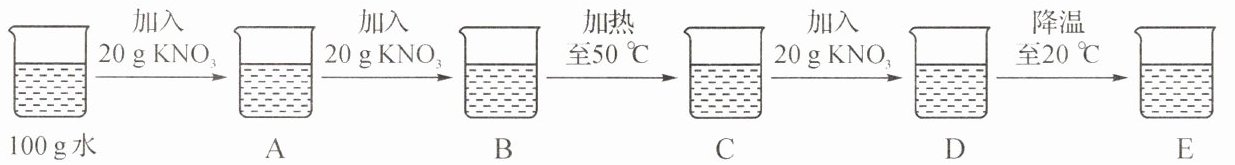
小明观察到$A$中所加固体全部溶解,则$B$中的现象是
固体部分溶解
。上述实验过程中属于不饱和溶液的是
ACD
。$D$中溶液的溶质质量分数是
37.5%
。
答案:12. (1)20 ℃时,KNO₃的溶解度是31.6 g
(2)固体部分溶解 ACD 37.5%