5. 某化学兴趣小组的同学对酸、碱和盐的性质进行探究,请你参与。
[查阅资料] CO₂ + Na₂CO₃ + H₂O = 2NaHCO₃
20℃时,部分物质的溶解度如下表所示。
探究一:探究氢氧化钙的性质。
20℃时,在盛有 5g Ca(OH)₂ 固体的 A 烧杯中加入 40mL 水,用玻璃棒搅拌,静置,取上层部分清液于 B 烧杯中。
(1)向 A 烧杯中滴加几滴酚酞溶液,观察到的现象是
溶液由无色变为红色
,再加入过量稀盐酸,反应的化学方程式为
Ca(OH)₂+2HCl=CaCl₂+2H₂O
。
(2)向 B 烧杯中通入 CO₂,观察到澄清石灰水变浑浊。
(3)由上述实验可知氢氧化钙的性质为
固体;微溶于水,能与指示剂作用;能与某些非金属氧化物反应生成盐和水;能与酸反应生成盐和水
。
[实验拓展]
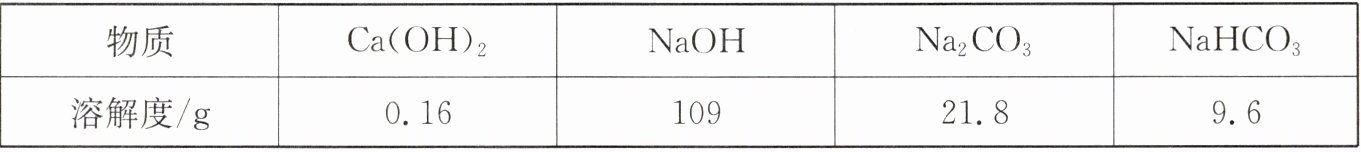
(4)向上述(1)反应后的 A 烧杯中滴加碳酸钠溶液,测得其 pH 随反应时间的变化如图甲所示。AB 段的实验现象是
产生大量气泡
,BC 段发生反应的化学方程式为
CaCl₂+Na₂CO₃=CaCO₃↓+2NaCl
。
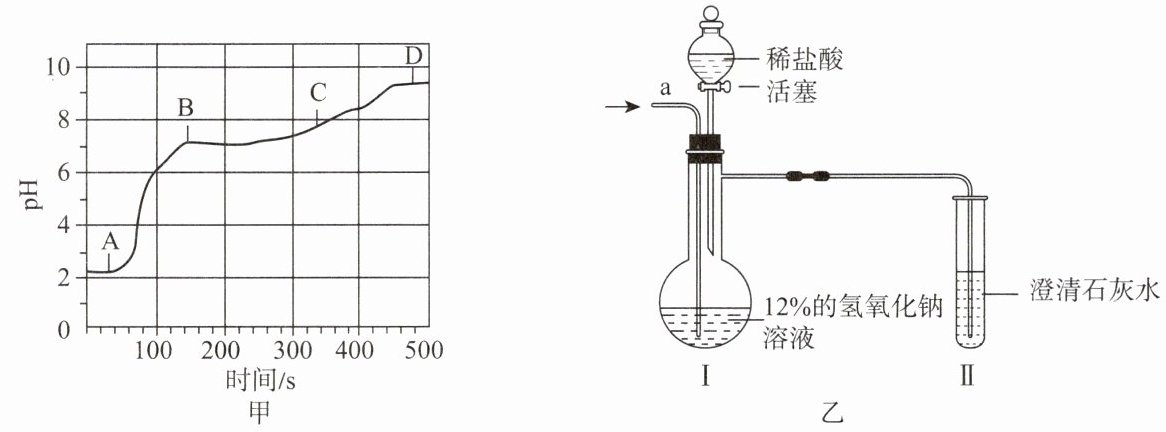
探究二:二氧化碳通入一定溶质质量分数的氢氧化钠溶液中溶质成分的探究。
[设计和实验] 20℃时,甲、乙两组同学设计如图乙所示装置分别进行实验。
(1)甲组:从 a 端缓慢通入 CO₂,一段时间后Ⅱ中溶液变浑浊,停止通 CO₂,Ⅰ中溶质为 X。打开活塞,滴加足量稀盐酸。
解释与结论:经分析 X 是 NaHCO₃。实验过程中,Ⅰ中产生的现象是
无色溶液中逐渐有固体析出(变浑浊),滴盐酸后有气泡产生,固体逐渐溶解(消失)
。
(2)乙组:从 a 端缓慢通入 CO₂,一段时间后Ⅱ中无明显现象,停止通 CO₂,Ⅰ中溶质为 Y。打开活塞,滴加足量稀盐酸,Ⅱ 中变浑浊。
解释与结论:乙组同学认为 Y 只有 Na₂CO₃。你认为该结论是否合理?
不合理
。结合分析 Y 的成分说明理由:
根据通入的CO₂的量的不同情况判断,Y的溶质成分可能还有NaOH和Na₂CO₃,Na₂CO₃和NaHCO₃,NaHCO₃这三种情况。三种情况均能与稀盐酸反应产生气体且使澄清石灰水变浑浊
。Ⅰ中一定发生反应的化学方程式为
2NaOH+CO₂=Na₂CO₃+H₂O
。