9. 利用一种特殊的催化剂可以有效消除室内装修材料释放的甲醛,该反应的微观示意图如图所示,下列说法正确的是(
D
)
A.丁的化学式为$ \text{CO}_2 $
B.丙、丁中氧元素的化合价不同
C.反应前后元素种类改变
D.反应过程中原子重新组合
答案:D 解析:根据反应的微观示意图可知,1个丁分子由1个氧原子和2个氢原子构成,其化学式为${H_{2}O}$,A错误;丙为二氧化碳,二氧化碳中氧元素的化合价为—2,丁为水,水中氧元素的化合价也为—2,丙和丁中氧元素的化合价相同,B错误;化学反应前后元素种类没有改变,C错误;反应前后原子种类没有改变,反应过程中原子重新组合成新的分子,D正确。故本题选D。
10. 如图为$ \text{KNO}_3 $饱和溶液的溶质质量分数($ w $)随温度($ T $)的变化曲线。$ M $、$ N $点分别表示三份$ \text{KNO}_3 $溶液的溶质质量分数和温度。当条件改变时,溶液新的状态在图中对应的点的位置可能也随之变化,下列判断不正确的是(
B
)
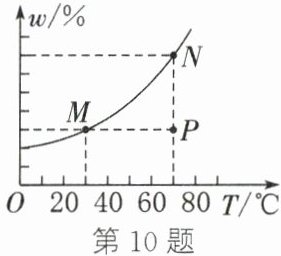
A.$ M $、$ N $点代表的是饱和溶液,$ P $点代表的是不饱和溶液
B.其他条件不变,加水稀释$ N $点溶液可使其移动至$ M $点
C.其他条件不变,将$ P $点或$ N $点溶液降温40℃后溶液均可至$ M $点
D.恒温蒸发溶剂时,$ M $、$ N $点均不动,$ P $点垂直上移可至$ N $点
答案:B 解析:由题意可知,图中曲线为${KNO_{3}}$饱和溶液的溶质质量分数随温度变化的曲线,$M$、$N$点处于曲线上,代表的溶液为饱和溶液,$P$点处于曲线下方,代表的溶液为不饱和溶液,A正确;其他条件不变时,溶液加水稀释后会由饱和变为不饱和,$N$点溶液和$M$点溶液都是饱和溶液,B错误;由图示可知,将$P$点溶液降温${40^{\circ}C}$后溶液移动至$M$点恰好达到饱和的状态,如果将$N$点溶液降温${40^{\circ}C}$后,溶液中会有晶体析出,也能到达$M$点达到饱和状态,C正确;恒温蒸发溶剂,溶剂变少,温度不变,饱和溶液的溶质质量分数不变,故恒温蒸发溶剂时,$M$、$N$点均不动,$P$点垂直上移可至$N$点,D正确。故本题选B。
11. (7分)水是一种重要的资源。如图甲是水的电解实验。
(1)图甲反应的文字表达式为
水$\xrightarrow{通电}$氢气$+$氧气
,该反应属于
分解反应
(填基本反应类型)。
(2)下列关于图甲实验的说法正确的是
C
(填字母)。
A. 试管a中得到的气体能使带火星的木条复燃
B. 实验前向水中加入少量氢氧化钠,目的是除去水中的杂质
C. 该实验能说明水由氢元素和氧元素组成
(3)过滤是一种常见的净水方法,实验装置如图乙所示,仪器b的名称是
漏斗
,进行操作时,发现装置存在一处明显错误,该错误是
漏斗下端没有紧靠烧杯内壁
。过滤时玻璃棒的作用是
引流
。
(4)如图丙是利用膜技术净水的过程示意图,经过超滤膜净化后的水属于
混合物
(填“纯净物”或“混合物”)。
答案:(1) 水$\xrightarrow{通电}$氢气$+$氧气 分解反应 (2) C (3) 漏斗 漏斗下端没有紧靠烧杯内壁 引流 (4) 混合物
12. (5分)20℃时,向质量均为50g的5份水中分别加入一定质量的氯化钾固体,然后搅拌至完全溶解得到溶液(若有不溶解的氯化钾,则过滤除去),加入氯化钾的质量与所得溶液的质量如表所示。
|实验编号|1|2|3|4|5|
|----|----|----|----|----|----|
|氯化钾的质量/g|5|10|15|20|25|
|溶液的质量/g|55|60|65|67|67|
(1)20℃时,实验3所得的溶液中溶质与溶剂的质量比为
3:10
(填最简整数比)。
(2)20℃时,实验5所得的溶液中溶质的质量为
17
g。
(3)20℃时,实验1所得的溶液为不饱和溶液,可以通过
加氯化钾(合理答案均可)
的方法使它变为饱和溶液。
(4)20℃时,所得溶液的溶质质量分数:实验3
<
实验4
=
实验5。(填“>”“<”或“=”)
答案:(1)$3:10$ (2) 17 (3) 加氯化钾(合理答案均可) (4)$\lt$ $=$ 解析:(1)${20^{\circ}C}$时,向质量为${50g}$的水中加入${15g}$氯化钾后得到${65g}$溶液,说明氯化钾全部溶解,所以${20^{\circ}C}$时,实验3所得的溶液中溶质与溶剂的质量比为${15g}:{50g}=3:10$。(2)${20^{\circ}C}$时,向质量为${50g}$的水中加入${25g}$氯化钾后得到${67g}$溶液,说明只有${67g}-{50g}={17g}$氯化钾溶解,所以在${20^{\circ}C}$时,实验5所得的溶液中溶质的质量为${17g}$。(3)${20^{\circ}C}$时,实验1所得的溶液为不饱和溶液,可以通过加氯化钾或蒸发水的方法使它变为饱和溶液。(4)在${20^{\circ}C}$时,实验3、4、5在${50g}$水中溶解氯化钾的质量分别为${65g}-{50g}={15g}$、${67g}-{50g}={17g}$、${67g}-{50g}={17g}$,所以在${20^{\circ}C}$时,所得溶液的溶质质量分数:实验3$\lt$实验4$=$实验5。
解析:
(1)3:10
(2)17
(3)加氯化钾(或蒸发水)
(4)<;=