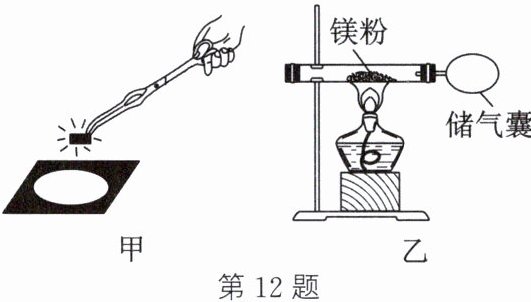
12. 化学兴趣小组同学为验证质量守恒定律,做了镁条在空气中燃烧的实验(如图甲)。
(1)镁条与氧气在点燃的条件下生成氧化镁,理论上得到的生成物的质量
大于
(填“大于”“小于”或“等于”)镁条的质量;经分析可知出现这一结果的原因是
生成物质量中多了参加反应的氧气的质量(合理答案均可)
。
(2)兴趣小组同学按图乙装置改进实验后,验证了质量守恒定律,同时发现燃烧产物中有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体,常温下与水不反应。②镁能与氮气反应生成黄色的氮化镁($Mg_{3}N_{2}$)固体。③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【作出猜想】黄色固体为$Mg_{3}N_{2}$。
【进行实验】同学们通过实验对猜想进行了验证,请你将实验记录表补充完整。
|实验操作|实验现象|结论|
|将镁粉燃烧的产物放在一支试管中,加入少量的蒸馏水,微热,然后将湿润的红色石蕊试纸放在试管口,观察现象|闻到刺激性气味,
湿润的红色石蕊试纸变成蓝色
|黄色固体为氮化镁|
【反思与交流】
①空气中氮气的含量远大于氧气的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁,是因为
氧气的化学性质比氮气活泼
。
②镁条
不能
(填“能”或“不能”)替代红磷做测定空气中氧气含量的实验,理由是
镁条不仅能和氧气反应,还能和氮气反应
。