6. “三效催化转化器”可将汽车尾气中的有毒气体处理为无毒气体,该反应的微观示意图如图所示。请回答:
(1)1个A分子中含有
3
个原子。
(2)A分子、B分子、C分子的相同点是
都含有氧原子(合理答案均可)
。
(3)反应物和生成物中,属于化合物的是
ABC
(填字母)。
(4)写出该反应的化学方程式:
$2NO₂+4CO\xlongequal {催化剂}4CO₂+N₂$
。
(5)反应中B和D的质量变化比为
4:1
(填最简整数比)。
答案:(1)3 (2)都含有氧原子(合理答案均可) (3)ABC (4)$2NO_{2}+4CO\xlongequal {催化剂}4CO_{2}+N_{2}$ (5)4:1
7. (2023·宿迁)我们的祖先很早就掌握了炼铜的工艺,他们将孔雀石[主要成分是$Cu_{2}(OH)_{2}CO_{3}$]和木炭一起加热得到了红色的铜。兴趣小组同学为测定某孔雀石中$Cu_{2}(OH)_{2}CO_{3}$的质量分数,进行如下实验:称取25g孔雀石样品,粉碎后放入烧杯,向其中加入200g稀硫酸(稀硫酸过量),充分反应后称量,烧杯内物质的总质量为220.6g。(假设杂质都不与稀硫酸发生反应)
(1)$Cu_{2}(OH)_{2}CO_{3}+2H_{2}SO_{4}\xlongequal{\;\;}2CuSO_{4}+CO_{2}\uparrow +3$
$H_{2}O$
。
(2)生成气体的质量是
4.4g
。
(3)求该孔雀石中$Cu_{2}(OH)_{2}CO_{3}$的质量分数。(写出计算过程)
解:设该孔雀石中$Cu_{2}(OH)_{2}CO_{3}$的质量为x。
$Cu_{2}(OH)_{2}CO_{3}+2H_{2}SO_{4}=2CuSO_{4}+CO_{2}\uparrow +3H_{2}O$
222 44
x 4.4g
$\frac {222}{44}=\frac {x}{4.4g}$ $x=22.2g$
该孔雀石中$Cu_{2}(OH)_{2}CO_{3}$的质量分数为$\frac {22.2g}{25g}×100\% =88.8\%$。
答:该孔雀石中$Cu_{2}(OH)_{2}CO_{3}$的质量分数为88.8%。
答案:(1)$H_{2}O$ (2)4.4g (3)解:设该孔雀石中$Cu_{2}(OH)_{2}CO_{3}$的质量为x。
$Cu_{2}(OH)_{2}CO_{3}+2H_{2}SO_{4}=2CuSO_{4}+CO_{2}\uparrow +3H_{2}O$
222 44
x 4.4g
$\frac {222}{44}=\frac {x}{4.4g}$ $x=22.2g$
该孔雀石中$Cu_{2}(OH)_{2}CO_{3}$的质量分数为$\frac {22.2g}{25g}×100\% =88.8\%$。
答:该孔雀石中$Cu_{2}(OH)_{2}CO_{3}$的质量分数为88.8%。
解析:(1)由反应的化学方程式可知,反应物中Cu、O、H、C、S的原子个数分别为2、13、6、1、2,生成物中已知的Cu、O、C、S的原子个数分别为2、10、1、2,根据化学反应前后各原子种类和数目不变、未知物的化学计量数为3可知,1个未知物分子由2个氢原子和1个氧原子构成,即未知物的化学式为$H_{2}O$。(2)根据质量守恒定律可知,生成气体的质量为25g+200g-220.6g=4.4g。
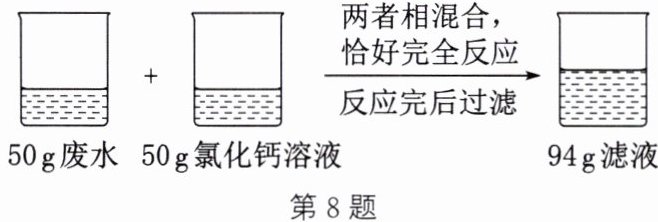
8. 某工厂排放的废水中含有亚硫酸钠($Na_{2}SO_{3}$),未经处理就排放会造成污染。化学兴趣小组的同学对废水处理设计了如图所示的实验方案。试计算:(已知$Na_{2}SO_{3}+CaCl_{2}\xlongequal{\;\;}CaSO_{3}\downarrow +2NaCl$;氯化钙不与废水中的其他杂质反应)
(1)反应完后生成亚硫酸钙沉淀的质量为
6
g。
(2)废水中亚硫酸钠的质量分数。(写出计算过程)
解:设50g废水中亚硫酸钠的质量为x。
$Na_{2}SO_{3}+CaCl_{2}=CaSO_{3}\downarrow +2NaCl$
126 120
x 6g
$\frac {126}{120}=\frac {x}{6g}$ $x=6.3g$
废水中亚硫酸钠的质量分数为$\frac {6.3g}{50g}×100\% =12.6\%$。
答:废水中亚硫酸钠的质量分数为12.6%。
答案:(1)6 (2)解:设50g废水中亚硫酸钠的质量为x。
$Na_{2}SO_{3}+CaCl_{2}=CaSO_{3}\downarrow +2NaCl$
126 120
x 6g
$\frac {126}{120}=\frac {x}{6g}$ $x=6.3g$
废水中亚硫酸钠的质量分数为$\frac {6.3g}{50g}×100\% =12.6\%$。
答:废水中亚硫酸钠的质量分数为12.6%。