6. 一定条件下,四种物质在密闭容器内充分反应,测得反应前后各物质的质量如表,下列说法正确的是 (
A
)
A.$X + Y = 75$
B.若$Y = 20$,则丁物质一定是催化剂
C.甲物质不可能是单质
D.甲和丙的相对分子质量之比一定是$4:1$
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | $20$ | $30$ | $15$ | $20$ |
| 反应后的质量/g | $0$ | $X$ | $10$ | $Y$ |
答案:A 解析:根据质量守恒定律,化学反应前后物质的总质量不变,由表中数据可知,$X + Y = 20+30+15+20-0-10=75$,A正确。若$Y = 20$,则丁物质在反应前后质量不变,丁物质可能是该反应的催化剂,也可能是不参与反应的杂质,B不正确。由表中数据可知,反应后甲的质量减少了$20g$,丙的质量减少了$5g$,则甲和丙都是反应物,该反应不可能是分解反应,所以反应物甲可能是单质也可能是化合物,C不正确。甲和丙的质量变化之比为$20g:5g=4:1$,由于不知道化学反应中,甲、丙前的化学计量数,所以无法判断甲和丙的相对分子质量之比,D不正确。故本题选A。
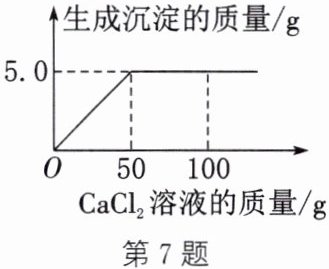
7. 氢氧化钠保存不当容易变质为碳酸钠,为测定一瓶久置的氢氧化钠的纯度,现取$20.0g$样品于烧杯中加水至完全溶解,然后逐滴加入$CaCl_{2}$溶液,反应过程中加入$CaCl_{2}$溶液的质量与生成沉淀的质量关系如图所示。(不考虑其他因素的影响,反应的化学方程式为$Na_{2}CO_{3} + CaCl_{2} = CaCO_{3}\downarrow + 2NaCl$)请根据图示计算:
(1)恰好完全反应时加入$CaCl_{2}$溶液的质量为
50
g。
(2)该样品中氢氧化钠的质量分数。
解:设该样品中碳酸钠的质量为$x$。
$Na_{2}CO_{3} + CaCl_{2} = CaCO_{3}\downarrow + 2NaCl$
$106$ $100$
$x$ $5.0g$
$\frac {106}{100}=\frac {x}{5.0g}$ $x=5.3g$
该样品中氢氧化钠的质量分数为$\frac {20.0g-5.3g}{20.0g}×100\% =73.5\%$。
答:该样品中氢氧化钠的质量分数为$73.5\%$。
答案:(1)$50$ (2)解:设该样品中碳酸钠的质量为$x$。
$Na_{2}CO_{3} + CaCl_{2} = CaCO_{3}\downarrow + 2NaCl$
$106$ $100$
$x$ $5.0g$
$\frac {106}{100}=\frac {x}{5.0g}$ $x=5.3g$
该样品中氢氧化钠的质量分数为$\frac {20.0g-5.3g}{20.0g}×100\% =73.5\%$。
答:该样品中氢氧化钠的质量分数为$73.5\%$。
8. 国家对化肥的销售有明确的质量标准。为检测铵态氮肥质量的优劣,可采用铵盐与氢氧化钠反应的方法。某同学称取$15g$硫酸铵样品(杂质不含氮元素),与足量的$NaOH$混合后,放入试管中加热,发生如下反应:$(NH_{4})_{2}SO_{4} + 2NaOH\xlongequal{\triangle}Na_{2}SO_{4} + 2H_{2}O + 2NH_{3}\uparrow$,充分反应后共收集到$3.4g NH_{3}$。
(1)$(NH_{4})_{2}SO_{4}$中氮元素的质量分数为
21.2%
(结果精确到$0.1\%$)。
(2)求样品中硫酸铵的质量。(写出计算过程)
解:设样品中硫酸铵的质量为$x$。
$(NH_{4})_{2}SO_{4} + 2NaOH\xlongequal{\triangle}Na_{2}SO_{4} + 2H_{2}O + 2NH_{3}\uparrow$
$132$ $34$
$x$ $3.4g$
$\frac {132}{34}=\frac {x}{3.4g}$ $x=13.2g$
答:样品中硫酸铵的质量为$13.2g$。
(3)合格的硫酸铵化肥中硫酸铵的质量分数为$94.3\%~99\%$,通过计算判断上述样品是否合格。
该硫酸铵样品中硫酸铵的质量分数为$\frac {13.2g}{15g}×100\% =88\% <94.3\%$,即该样品不合格。
答:该样品不合格。
答案:(1)$21.2\%$ 解:(2)设样品中硫酸铵的质量为$x$。
$(NH_{4})_{2}SO_{4} + 2NaOH\xlongequal{\triangle}Na_{2}SO_{4} + 2H_{2}O + 2NH_{3}\uparrow$
$132$ $34$
$x$ $3.4g$
$\frac {132}{34}=\frac {x}{3.4g}$ $x=13.2g$
(3)该硫酸铵样品中硫酸铵的质量分数为$\frac {13.2g}{15g}×100\% =88\% <94.3\%$,即该样品不合格。
答:(2)样品中硫酸铵的质量为$13.2g$。(3)该样品不合格。
9. 已知$AgNO_{3}$受热可发生如下反应:$aAgNO_{3}\xlongequal{\triangle}bAg + cX\uparrow + dO_{2}\uparrow$。取$AgNO_{3}固体170g$,充分加热,使之完全分解。将产生的气体产物通过足量灼热的铜粉(已知$X$气体不能与铜粉反应),铜粉质量增加$16g$。下列说法正确的是 (
D
)
A.$X的化学式可能是CO$
B.生成银的质量为$54g$
C.生成$O_{2}和X气体的总质量为52g$
D.化学方程式中$a:d = 2:1$
答案:D 解析:由质量守恒定律可知,反应前含有$Ag$、$N$、$O$三种元素,没有$C$元素,反应后不可能生成$CO$,A错误;由质量守恒定律可知,生成银的质量等于硝酸银中银元素的质量,银元素的质量为$170g×(\frac {108}{170}×100\% )=108g$,B错误;生成$O_{2}和X$气体的总质量为$170g-108g=62g$,C错误;将产生的气体产物通过足量灼热的铜粉(已知$X$气体不能与铜粉反应),铜和氧气反应生成氧化铜,铜粉增加的质量即为参加反应的氧气的质量,即反应生成氧气的质量为$16g$,该化学方程式中$a:d=\frac {170g}{170}:\frac {16g}{32}=2:1$,D正确。故本题选D。