1. 在反应$2A + 3B = C + 2D$中,$36g A与56g B恰好完全反应产生28g C和一定质量的D$,若$C的相对分子质量为14$,则$C和D$的相对分子质量之比为 (
A
)
A.$7:8$
B.$7:1$
C.$7:16$
D.$7:3$
答案:A 解析:在反应$2A + 3B = C + 2D$中,$36g A$与$56g B$恰好完全反应生成$28g C$和一定质量的$D$,根据质量守恒定律可知,同时生成$D$的质量为$36g+56g-28g=64g$;设$D$的相对分子质量为$x$,则:
$2A+3B=C+2D$
$14$ $2x$
$28g$ $64g$
$\frac {14}{2x}=\frac {28g}{64g}$ $x=16$
则$C$和$D$的相对分子质量之比为$14:16=7:8$。故本题选A。
2. 等质量的水和过氧化氢完全分解后,生成氧气的质量关系是 (
B
)
A.生成的氧气质量一样多
B.水生成的氧气质量多
C.过氧化氢生成的氧气质量多
D.无法判断
答案:B 解析:设水和过氧化氢的质量均为$m$,水分解生成氧气的质量为$x$,过氧化氢分解生成氧气的质量为$y$。
$2H_{2}O\xlongequal {通电}2H_{2}\uparrow +O_{2}\uparrow$
$36$ $32$
$m$ $x$
$\frac {36}{32}=\frac {m}{x}$ $x=\frac {32}{36}m$
$2H_{2}O_{2}\xlongequal {MnO_{2}}2H_{2}O+O_{2}\uparrow$
$68$ $32$
$m$ $y$
$\frac {68}{32}=\frac {m}{y}$ $y=\frac {32}{68}m$
由于$x$大于$y$,因此水生成的氧气质量多。故本题选B。
3. 铝粉和氢氧化钠溶液能发生化学反应:$2Al + 2NaOH + 2H_{2}O = 2NaAlO_{2} + 3H_{2}\uparrow$,现有$30g含铝90\%$的铝粉样品,加入足量氢氧化钠溶液中充分反应(样品中其他成分不反应)。求反应后产生氢气的质量。
答案:解:铝粉样品中铝的质量为$30g×90\% =27g$。设反应后产生氢气的质量为$x$。
$2Al+2NaOH+2H_{2}O=2NaAlO_{2}+3H_{2}\uparrow$
$54$ $6$
$27g$ $x$
$\frac {54}{6}=\frac {27g}{x}$ $x=3g$
答:反应后产生氢气的质量为$3g$。
4.(2025·宿迁宿城二模)由于煤燃烧会产生大量的污染,因此在煤中加入适量的生石灰($CaO$)制成供居民取暖的“环保煤”,以减少$SO_{2}$的排放。燃烧时生石灰吸收$SO_{2}$的反应的化学方程式如下:$2CaO + 2SO_{2} + X\xlongequal{高温}2CaSO_{4}$。
(1)$X$的化学式为
$O_{2}$
。
(2)若煤厂要处理$16t$二氧化硫,根据化学方程式计算至少需要加入生石灰的质量。
解:设至少需要加入生石灰的质量为$x$。
$2CaO+2SO_{2}+O_{2}\xlongequal {高温}2CaSO_{4}$
$112$ $128$
$x$ $16t$
$\frac {112}{128}=\frac {x}{16t}$ $x=14t$
答:至少需要加入生石灰的质量是$14t$。
答案:(1)$O_{2}$ (2)解:设至少需要加入生石灰的质量为$x$。
$2CaO+2SO_{2}+O_{2}\xlongequal {高温}2CaSO_{4}$
$112$ $128$
$x$ $16t$
$\frac {112}{128}=\frac {x}{16t}$ $x=14t$
答:至少需要加入生石灰的质量是$14t$。
解析:(1)由$2CaO + 2SO_{2} + X\xlongequal{高温}2CaSO_{4}$可知,反应物中除$X$外,$Ca$、$O$、$S$原子的个数分别为$2$、$6$、$2$,生成物中$Ca$、$O$、$S$原子的个数分别为$2$、$8$、$2$,$X$的化学计量数为$1$,根据化学反应前后各原子的种类和数目不变,所以$1$个$X$分子由$2$个氧原子构成,$X$的化学式为$O_{2}$。
5. 实验室用高锰酸钾制取氧气,某次实验中固体的质量变化如图所示。
(1)生成氧气的质量是多少?
(2)反应后剩余固体混合物中二氧化锰的质量是多少?
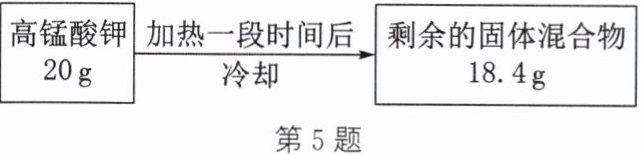
答案:解:(1)根据质量守恒定律,化学反应前后物质的总质量不变,则反应生成氧气的质量为$20g-18.4g=1.6g$。(2)设反应生成二氧化锰的质量为$x$。
$2KMnO_{4}\xlongequal {△}K_{2}MnO_{4}+MnO_{2}+O_{2}\uparrow$
$87$ $32$
$x$ $1.6g$
$\frac {87}{32}=\frac {x}{1.6g}$ $x=4.35g$
答:(1)生成氧气的质量是$1.6g$。(2)反应后剩余固体混合物中二氧化锰的质量为$4.35g$。