6. (2024·云南)实验室中存放有如图所示的氯化钾溶液。下列说法错误的是 (
D
)
A.该溶液中的溶剂是水
B.该溶液的溶质质量分数为6%
C.配制100g该溶液需要6gKCl
D.该溶液取出一半后,溶质质量分数变为3%
答案:D
解析:
A. 溶液中溶剂通常为水,正确。
B. 标签显示溶质质量分数为6%,正确。
C. 100g×6%=6g,正确。
D. 溶液具有均一性,取出一半后溶质质量分数仍为6%,错误。
答案:D
7. 现有90g10%的硝酸钠溶液,试计算:
(1) 向上述溶液中加入10g水,所得溶液中溶质的质量分数。
(2) 向上述溶液中加入10g硝酸钠(硝酸钠完全溶解),所得溶液中溶质的质量分数。
(3) 把上述溶液蒸发掉20g水(烧杯中无固体析出),所得溶液中溶质的质量分数。(结果精确至0.1%)
答案:解: (1) 向 90g 10%的硝酸钠溶液中加入 10g 水, 所得溶液中溶质的质量分数是 $\frac{90g × 10\%}{90g + 10g} × 100\% = 9\%$。(2) 向 90g 10%的硝酸钠溶液中加入 10g 硝酸钠(硝酸钠完全溶解), 所得溶液中溶质的质量分数是 $\frac{90g × 10\% + 10g}{90g + 10g} × 100\% = 19\%$。(3) 将 90g 10%的硝酸钠溶液蒸发掉 20g 水(烧杯中无固体析出), 所得溶液中溶质的质量分数是 $\frac{90g × 10\%}{90g - 20g} × 100\% \approx 12.9\%$。
答: (1) 加入 10g 水后所得溶液中溶质的质量分数是 9%。(2) 加入 10g 硝酸钠完全溶解后所得溶液中溶质的质量分数是 19%。(3) 蒸发掉 20g 水(烧杯中无固体析出)后所得溶液中溶质的质量分数约为 12.9%。
8. (2024·宿迁期中)溶液对动植物的生理活动和人类的生产、科研活动具有重要意义。室温下,某同学欲配制50g溶质质量分数为10%的氯化钠溶液,请回答下列问题:
(1) 计算:需要氯化钠固体的质量是
5
g。
(2) 称量:
① 用图中字母表示正确配制该溶液的操作顺序:
cbdea
。
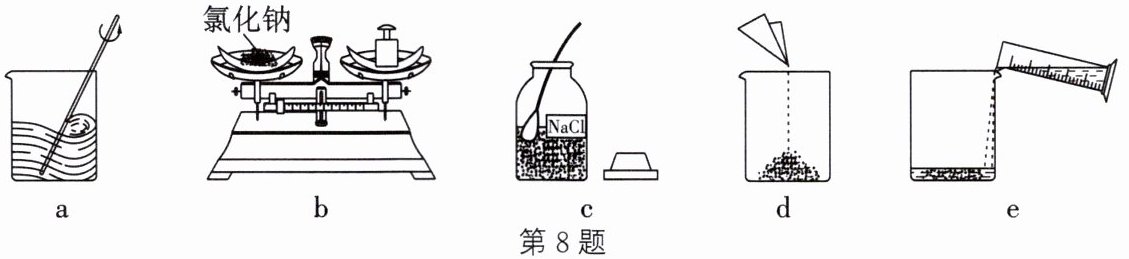
② 用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应
B
(填字母)。
A. 增加适量氯化钠固体
B. 减少适量氯化钠固体
C. 调节游码
D. 添加砝码
(3) 溶解:将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是
加快氯化钠的溶解速率
。
(4) 反思:经检测,所配制氯化钠溶液的溶质质量分数偏大,其原因可能是
①②
(填序号)。
① 用量筒量取水时,俯视读数
② 砝码生锈
③ 用量筒量取水时,仰视读数
④ 用于溶解的烧杯中有少量的蒸馏水
⑤ 转移溶液时有部分液体溅出
⑥ 试剂、砝码的左右位置颠倒且使用了游码
答案:(1) 5 (2) ① cbdea ② B (3) 加快氯化钠的溶解速率 (4) ①②
9. (2025·宿迁段考)下列关于“水的蒸馏”实验的说法错误的是 (
C
)
A.表面皿底部出现的水是纯净物
B.实验时会看到玻璃片上的水消失,无任何物质残留
C.蒸馏属于物理变化,水分子种类发生改变
D.蒸馏过程中,水分子之间的间隔先变大后变小
答案:C