8. (教材 P75 练习与应用 T4 变式)同学们欲配制 50g 溶质质量分数为 6%的氯化钠溶液,图甲中是老师提供的仪器,请同学们从中选取部分仪器。
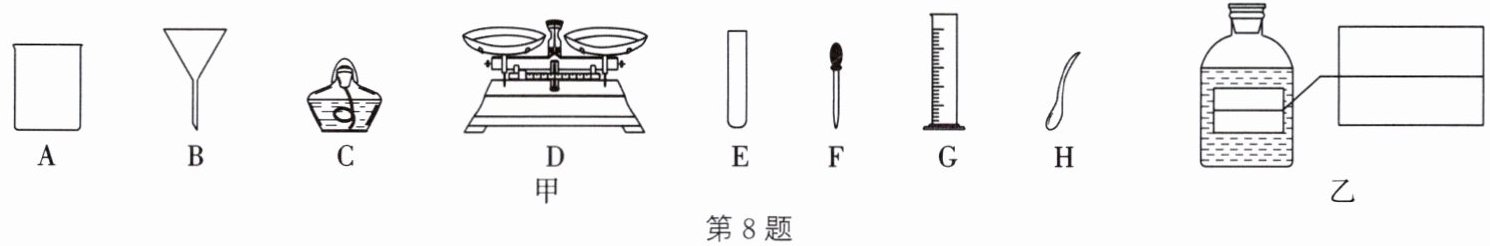
(1) 计算:配制 50g 溶质质量分数为 6%的氯化钠溶液,所需氯化钠的质量为______。
(2) 称量:取用氯化钠的仪器为______(填名称),称取氯化钠时分别在托盘天平左右两盘放上等质量的纸片,调节平衡后,接下来的操作是______(填序号)。
① 先添加砝码或移动游码到所需位置,再添加氯化钠直到天平平衡
② 先添加所需的氯化钠,再添加砝码或移动游码直到天平平衡
(3) 量取:量取水时需要的仪器有量筒和______(填名称),应选用量筒的规格是______(填“10mL”“25mL”“50mL”或“100mL”)。
(4) 溶解:将称量好的氯化钠和蒸馏水混合溶解,此时发现缺少一种玻璃仪器,所缺仪器的作用是______。
(5) 反思:若称取的氯化钠中含有水分,则已配制好的溶液的溶质质量分数会______(填“偏大”“偏小”或“不变”,下同),将已配制好的溶液往细口瓶中倾倒时洒出来一些,则溶液的溶质质量分数会______。
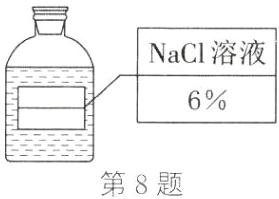
(6) 请帮同学们把图乙中的标签填好。
答案:(1) $3\mathrm{g}$ (2) 药匙 ① (3) 胶头滴管 $50\mathrm{mL}$ (4) 搅拌, 加速溶解 (5) 偏小 不变 (6) 如图所示
9. 医生给病人输液时,常用葡萄糖注射液。如图为葡萄糖注射液的部分标签图,回答下列问题。

(1) 从该溶液中取出 100g,则取出的溶液中溶质的质量分数为
5%
。
(2) 某病人一天共输人该葡萄糖注射液 10g,此病人这一天共补充葡萄糖
0.5
g。
(3) 如果从瓶中取出 200g,将它变成 2%的葡萄糖注射液,需要加入水的质量为
300
g。
答案:(1) $5\%$ (2) $0.5$ (3) $300$ 解析: (1) 由题图可知, 该葡萄糖注射液中溶质的质量分数为 $5\%$, 因溶液具有均一性, 任意取出一定量时, 溶质的质量分数不变, 故取出的溶液中溶质的质量分数为 $5\%$。(2) 某病人一天共输入 $10\mathrm{g}$ 该葡萄糖注射液, 此病人这一天共补充葡萄糖的质量为 $10\mathrm{g}× 5\% = 0.5\mathrm{g}$。(3) 设需要加入水的质量为 $x$。$200\mathrm{g}× 5\% = (200\mathrm{g} + x)× 2\%$, $x = 300\mathrm{g}$。
解析:
(1) 5%
(2) 0.5
(3) 解:设需要加入水的质量为$x$。
$200\mathrm{g}×5\%=(200\mathrm{g}+x)×2\%$
$10\mathrm{g}=4\mathrm{g}+0.02x$
$0.02x=6\mathrm{g}$
$x=300\mathrm{g}$
答:需要加入水的质量为$300\mathrm{g}$。
10. 如表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20°C),回答下列问题:
|溶液中溶质的质量分数/%|4|12|16|24|28|
|硫酸溶液的密度/($g\cdot mL^{-1}$)|1.02|1.08|1.11|1.17|1.20|
|氨水的密度/($g\cdot mL^{-1}$)|0.98|0.95|0.94|0.91|0.90|
(1) 20°C时,随着溶液中溶质的质量分数逐渐增大,氨水的密度逐渐
减小
。
(2) 取 12%的硫酸溶液 100mL,可配制成 6%的硫酸溶液
216
g。
(3) 向 100g 24%的氨水中加入 100g 水,摇匀,所得溶液体积是
210.5mL
(结果精确到 0.1mL)。
(4) 配制溶质质量分数为 4%的硫酸溶液 50mL,需要溶质质量分数为 24%的硫酸溶液的体积是
7.3mL
(结果精确到 0.1mL)。
答案:(1) 减小 (2) $216$ (3) $210.5\mathrm{mL}$ (4) $7.3\mathrm{mL}$ 解析: (1) 由题表中的数据可知, $20^{\circ}C$ 时, 随着溶液中溶质的质量分数逐渐增大, 氨水的密度逐渐减小。(2) 设可配制 $6\%$ 的硫酸溶液的质量为 $x$, 则 $100\mathrm{mL}× 1.08\mathrm{g/mL}× 12\% = x× 6\%$, 解得 $x = 216\mathrm{g}$。(3) 向 $100\mathrm{g}24\%$ 的氨水中加入 $100\mathrm{g}$ 水, 摇匀后所得溶液的溶质质量分数为 $\frac{100\mathrm{g}× 24\%}{100\mathrm{g} + 100\mathrm{g}}× 100\% = 12\%$, 由表可知, 溶质质量分数为 $12\%$ 的氨水的密度为 $0.95\mathrm{g/mL}$, 则该溶液的体积为 $\frac{200\mathrm{g}}{0.95\mathrm{g/mL}} \approx 210.5\mathrm{mL}$。(4) 设需要溶质质量分数为 $24\%$ 的硫酸溶液的体积为 $V$。$50\mathrm{mL}× 1.02\mathrm{g/mL}× 4\% = V× 1.17\mathrm{g/mL}× 24\%$, 解得 $V \approx 7.3\mathrm{mL}$。
解析:
(1) 减小
(2) 解:设可配制成6%的硫酸溶液的质量为$x$
$100\,\text{mL} × 1.08\,\text{g/mL} × 12\% = x × 6\%$
解得$x = 216\,\text{g}$
(3) 解:所得溶液溶质质量分数为$\frac{100\,\text{g} × 24\%}{100\,\text{g} + 100\,\text{g}} × 100\% = 12\%$
由表可知12%氨水密度为$0.95\,\text{g/mL}$,溶液体积为$\frac{200\,\text{g}}{0.95\,\text{g/mL}} \approx 210.5\,\text{mL}$
(4) 解:设需要24%硫酸溶液的体积为$V$
$50\,\text{mL} × 1.02\,\text{g/mL} × 4\% = V × 1.17\,\text{g/mL} × 24\%$
解得$V \approx 7.3\,\text{mL}$