1. 经实验测定,某物质中只含有一种元素,则该物质 (
D
)
A.一定是单质
B.一定是纯净物
C.一定是混合物
D.一定不是化合物
答案:D
解析:
解:
单质是由同种元素组成的纯净物,但只含一种元素的物质可能是混合物(如氧气和臭氧的混合物),故A错误。
纯净物只由一种物质组成,只含一种元素的物质可能是混合物,故B错误。
只含一种元素的物质也可能是纯净物(如单质),故C错误。
化合物是由不同种元素组成的纯净物,所以只含一种元素的物质一定不是化合物,故D正确。
答案:D
2. (易错易混)下列各组物质按单质、化合物、混合物的顺序排列的是 (
A
)
A.氮气、过氧化氢、海水
B.金刚石、氧化铜、高锰酸钾
C.空气、水银、牛奶
D.铁、氧化镁、冰水混合物
答案:A [易错分析]进行物质分类时,应先根据所含物质的种类判断该物质是纯净物还是混合物,“一物”的为纯净物,“多物”的为混合物,再在纯净物的基础上,根据组成物质的元素种类将物质分为单质和化合物,即“一物一素”的为单质,“一物多素”的为化合物。
3. 下列关于微观粒子的说法,错误的是 (
A
)
A.分子的质量一定比原子的质量大
B.同种原子可以构成不同种分子
C.所有原子都由原子核和核外电子构成
D.原子得到或失去电子变成离子
答案:A
4. 核污水中有碳-14(质子数为 6,相对原子质量为 14)等难以去除的放射性物质。下列说法错误的是 (
B
)
A.碳-14 的核电荷数为 6
B.碳-14 的中子数为 14
C.碳-14 原子中,质子数等于核外电子数
D.碳-14 原子的质量主要集中在原子核上
答案:B
解析:
解:
A. 核电荷数=质子数=6,正确。
B. 中子数=相对原子质量-质子数=14-6=8,错误。
C. 原子中质子数=核外电子数,正确。
D. 原子质量主要集中在原子核上,正确。
结论:B
5. (2024·宿迁泗洪期中)人类不同阶段认识原子的模型示意图如图,其中卢瑟福的“α粒子轰击金箔”实验对认识原子起到了关键作用。结合你所学的知识判断下列说法不正确的是 (
C
)
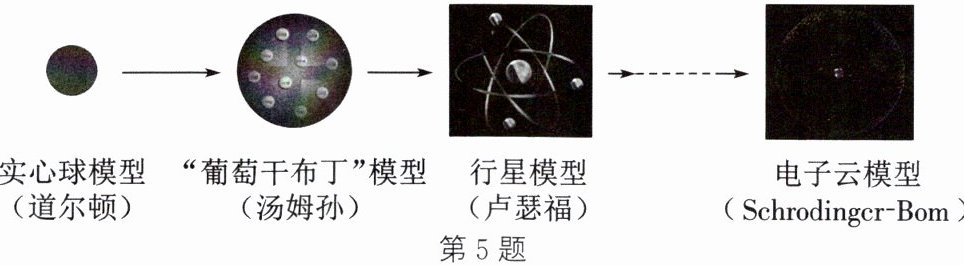
A.汤姆孙发现了电子,推翻了道尔顿原子不可再分的认识
B.科学模型的建立是一个不断完善、不断修正的过程
C.“α粒子轰击金箔”实验中极少数α粒子发生反弹,说明原子的质量很小
D.人类借助模型的建立,对原子的认识逐渐接近本质
答案:C
6. 作为相对原子质量标准的一个碳-12 原子的质量是$ 1.993×10⁻^2^6 kg,$现有 24 g 镁粉,则这些镁粉中含有镁原子的个数约为(镁的相对原子质量为 24) (
A
)
$A. 6.02×10^2^3 B. 5.02×10^2^5$
$C. 6.02×10^2^6 D. 5.02×10^2^2$
答案:A 解析:根据某原子的相对原子质量 = $\frac{一个原子的实际质量}{一个碳 - 12原子的实际质量×\frac{1}{12}}$,可求出一个镁原子的实际质量为 $1.993×10^{-26}kg×\frac{1}{12}×24 = 3.986×10^{-26}kg = 3.986×10^{-23}g$,则 $24g$ 镁粉中含有镁原子的个数为 $\frac{24g}{3.986×10^{-23}g}\approx6.02×10^{23}$。故本题选 A。