17. 在密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及$t_{1}$s、$t_{2}$s时各物质质量变化的情况如图,下列说法正确的是 (
D
)
A.该反应的基本反应类型为分解反应
B.丙一定是该反应的催化剂
C.生成丁的质量为8g
D.参加反应的甲、乙的质量比为5:2
答案:D
解析:反应后质量增加的是生成物,减少的是反应物,由图中信息可知,反应后丁的质量增加了 $ 8g - 1g = 7g $,是生成物;乙的质量减少了 $ 3g - 1g = 2g $,是反应物;丙的质量不变,可能未参与反应,也可能是该反应的催化剂;甲的质量减少了 $ 5g - 0g = 5g $,所以甲是反应物,故反应物是甲和乙,生成物是丁,该反应的基本反应类型是化合反应,A 错误;丙的质量不变,可能是该反应的催化剂,也可能是与反应无关的物质,B 错误;生成丁的质量为 7g,C 错误;参加反应的甲、乙的质量比为 $ 5g : 2g = 5 : 2 $,D 正确。故本题选 D。
18. 利用天然气制氨加工成尿素$[CO(NH_{2})_{2}]$的主要流程如图。
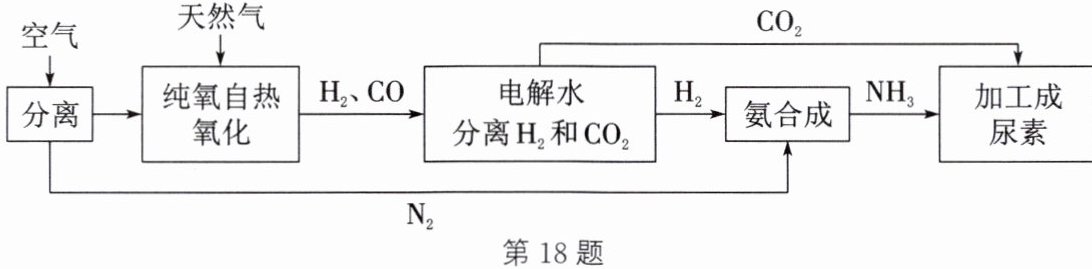
(1) 水电解反应的化学方程式为
$ 2H_2O \xlongequal{通电} 2H_2 \uparrow + O_2 \uparrow $
。
(2) 氨合成过程发生反应的基本反应类型是
化合反应
。
(3) 生成尿素反应的化学方程式为$2NH_{3}+CO_{2}\xlongequal{一定条件}CO(NH_{2})_{2}+H_{2}O$。若34kg$NH_{3}$完全转化,可生产尿素
60
kg。
答案:(1) $ 2H_2O \xlongequal{通电} 2H_2 \uparrow + O_2 \uparrow $
(2) 化合反应
(3) 60
19. 我国明代科技著作《天工开物》中有利用炉甘石(主要成分是$ZnCO_{3}$)火法炼锌的工艺记载,主要反应原理为$ZnCO_{3}+2C\xlongequal{高温}Zn+3CO\uparrow$,现用200kg炉甘石与足量碳充分反应,产生CO的质量与加热时间的关系如图所示。
(1) 此过程中产生CO的质量是
84
kg。
(2) 计算此炉甘石中$ZnCO_{3}$的质量分数。

解:设 200kg 炉甘石中 $ ZnCO_3 $ 的质量为 x。
$\begin{aligned}ZnCO_3 + 2C &\xlongequal{高温} Zn + 3CO \uparrow\\125 &\quad 84\\x &\quad 84kg\end{aligned}$
$\frac{125}{84} = \frac{x}{84kg} \quad x = 125kg$
炉甘石中 $ ZnCO_3 $ 的质量分数为 $ \frac{125kg}{200kg} × 100\% = 62.5\% $。
答:此炉甘石中 $ ZnCO_3 $ 的质量分数为 62.5%。
答案:(1) 84
(2) 解:设 200kg 炉甘石中 $ ZnCO_3 $ 的质量为 x。
$\begin{aligned}ZnCO_3 + 2C &\xlongequal{高温} Zn + 3CO \uparrow\\125 &\quad 84\\x &\quad 84kg\end{aligned}$
$\frac{125}{84} = \frac{x}{84kg} \quad x = 125kg$
炉甘石中 $ ZnCO_3 $ 的质量分数为 $ \frac{125kg}{200kg} × 100\% = 62.5\% $。
答:此炉甘石中 $ ZnCO_3 $ 的质量分数为 62.5%。
解析:(1) 由图像可知,此过程中产生 CO 的质量为 84kg。
20. 根据如图实验过程和数据计算(假设恰好完全反应,$K_{2}CO_{3}+CaCl_{2}= CaCO_{3}\downarrow +2KCl$)。
(1) 加入足量水后,搅拌的作用是
加速溶解
。
(2) 求固体混合物中$K_{2}CO_{3}$的质量分数。(写出计算过程,下同)
(3) 若所得滤液的质量为100g,求所得滤液中溶质的质量分数。

解:(2) 依据题意可知 $ K_2CO_3 $ 与 $ CaCl_2 $ 反应生成 $ CaCO_3 $ 沉淀的质量为 10g。设固体混合物中 $ K_2CO_3 $ 的质量为 x,生成 KCl 的质量为 y。
$\begin{aligned}K_2CO_3 + CaCl_2 &= CaCO_3 \downarrow + 2KCl\\138 &\quad 100 \quad 149\\x &\quad 10g \quad y\end{aligned}$
$\frac{138}{100} = \frac{x}{10g} \quad x = 13.8g$
$\frac{100}{149} = \frac{10g}{y} \quad y = 14.9g$
固体混合物中 $ K_2CO_3 $ 的质量分数为 $ \frac{13.8g}{15g} × 100\% = 92\% $。
(3) 所得滤液中 KCl 的质量为 $ 15g - 13.8g + 14.9g = 16.1g $。
所得滤液中溶质的质量分数为 $ \frac{16.1g}{100g} × 100\% = 16.1\% $。
答:(2) 固体混合物中 $ K_2CO_3 $ 的质量分数为 92%。(3) 所得滤液中溶质的质量分数为 16.1%。
答案:(1) 加速溶解
解:(2) 依据题意可知 $ K_2CO_3 $ 与 $ CaCl_2 $ 反应生成 $ CaCO_3 $ 沉淀的质量为 10g。设固体混合物中 $ K_2CO_3 $ 的质量为 x,生成 KCl 的质量为 y。
$\begin{aligned}K_2CO_3 + CaCl_2 &= CaCO_3 \downarrow + 2KCl\\138 &\quad 100 \quad 149\\x &\quad 10g \quad y\end{aligned}$
$\frac{138}{100} = \frac{x}{10g} \quad x = 13.8g$
$\frac{100}{149} = \frac{10g}{y} \quad y = 14.9g$
固体混合物中 $ K_2CO_3 $ 的质量分数为 $ \frac{13.8g}{15g} × 100\% = 92\% $。
(3) 所得滤液中 KCl 的质量为 $ 15g - 13.8g + 14.9g = 16.1g $。
所得滤液中溶质的质量分数为 $ \frac{16.1g}{100g} × 100\% = 16.1\% $。
答:(2) 固体混合物中 $ K_2CO_3 $ 的质量分数为 92%。(3) 所得滤液中溶质的质量分数为 16.1%。