15. (2024·包头)某实验室测定刚购进的大理石中碳酸钙的质量分数。取 $12g$ 大理石样品于烧杯中,加入一定质量的溶质质量分数为 $10\%$ 的稀盐酸至恰好完全反应,反应后将烧杯中的物质过滤、洗涤、干燥,得到不溶物 $2g$(杂质不溶于水,也不与酸反应)。计算:
(1)该大理石中碳酸钙的质量分数(结果精确到 $0.1\%$)。
(2)所用稀盐酸的质量。
(3)恰好完全反应时所得溶液的质量。
答案:解:(1) 根据题意可知,12 g 大理石样品中杂质的质量为 2 g,则碳酸钙的质量为 $ 12 g - 2 g = 10 g $,该大理石中碳酸钙的质量分数为 $ \frac{10 g}{12 g} × 100\% \approx 83.3\% $。 (2) 设所加入的稀盐酸的质量为 x,反应生成二氧化碳的质量为 y。 $\begin{aligned}CaCO_3 + 2HCl &= CaCl_2 + CO_2 \uparrow + H_2O\\100 &\quad 73 \quad \quad \quad 44\\10 g &\quad 10\% × x \quad y\end{aligned}$ $ \frac{100}{73} = \frac{10 g}{10\% × x} $ $ x = 73 g $ $ \frac{100}{44} = \frac{10 g}{y} $ $ y = 4.4 g $ (3) 根据化学反应前后物质的总质量不变可知,反应后溶液的总质量为 $ 12 g + 73 g - 2 g - 4.4 g = 78.6 g $。 答:(1) 该大理石中碳酸钙的质量分数为 83.3%。 (2) 所用稀盐酸的质量为 73 g。 (3) 恰好完全反应时所得溶液的质量为 78.6 g。
解析:
(1) 解:大理石中碳酸钙的质量为 $12g - 2g = 10g$,质量分数为 $\frac{10g}{12g} × 100\% \approx 83.3\%$。
(2) 解:设所用稀盐酸的质量为 $x$,生成二氧化碳的质量为 $y$。
$\begin{aligned}CaCO_3 + 2HCl &= CaCl_2 + CO_2 \uparrow + H_2O \\100 &\quad 73 \quad \quad \quad 44 \\10g &\quad 10\%x \quad \quad y\end{aligned}$
$\frac{100}{73} = \frac{10g}{10\%x}$,解得 $x = 73g$;
$\frac{100}{44} = \frac{10g}{y}$,解得 $y = 4.4g$。
(3) 解:所得溶液的质量为 $12g + 73g - 2g - 4.4g = 78.6g$。
答:(1) 83.3%;(2) 73g;(3) 78.6g。
1. 某兴趣小组同学基于碳中和理念设计低碳行动方案。
(1)说碳:低碳行动中的“碳”指的是
二氧化碳
。
(2)寻碳:小组同学通过查阅资料,归纳出自然环境中的碳循环如图所示。
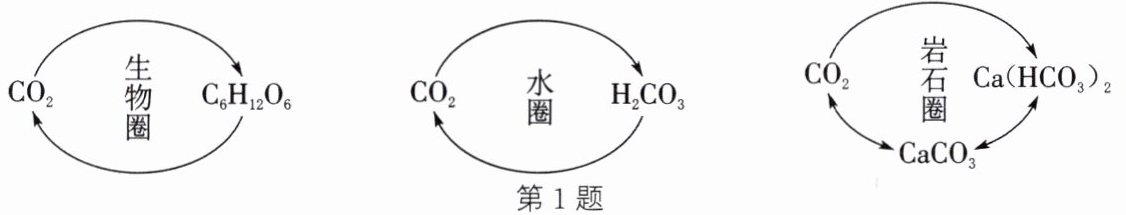
① 生物圈中,二氧化碳通过
光合
作用转化为葡萄糖($C_{6}H_{12}O_{6}$)和氧气。
② 水圈中,若大气中二氧化碳含量增加,会导致海水的酸性
增强
(填“增强”或“减弱”)。
③ 岩石圈中,石灰岩(主要成分是碳酸钙)在二氧化碳和水的作用下经化合反应转化为碳酸氢钙$[Ca(HCO_{3})_{2}]$,反应的化学方程式是
$ CaCO_3 + CO_2 + H_2O = Ca(HCO_3)_2 $
。
(3)控碳:科学家预测,到 2050 年主要控碳途径对全球碳中和的贡献率如表所示:
|途径|碳替代|碳减排|碳封存|碳循环|
|贡献率|47%|21%|15%|17%|
由表中数据可知,贡献率最大的途径是
碳替代
。
答案:(1) 二氧化碳 (2) ① 光合 ② 增强 ③ $ CaCO_3 + CO_2 + H_2O = Ca(HCO_3)_2 $ (3) 碳替代