23. (11 分)同学们对铁及其化合物的问题进行探究。
探究一:铁的应用
(1) 《天工开物》中记载:取盐井水“入于釜中煎炼,顷刻结盐”。煎炼时利用铁釜的
导热
性。生活中,铁粉常用作脱氧剂,原理是
铁能与空气中的氧气和水蒸气发生化学反应
。
探究二:FeOOH(羟基氧化铁)在化工、建筑、医药等方面有着广泛应用
(2) 火星探测器发回的信息表明,火星上存在 FeOOH,从而证明火星表面曾经存在过水,其理由为
$\mathrm{FeOOH}$中含有氢、氧元素
。
(3) 活性 FeOOH 可除去石油开采过程中的有害气体 H₂S,并获得 S,原理如下:
FeOOH $\xrightarrow[过程1]{H_{2}S}$ Fe$_{2}$S$_{3}$·H$_{2}$O $\xrightarrow[空气]{过程2}$ FeOOH + S与氢氧化钠溶液吸收 H₂S 气体相比,FeOOH 除去 H₂S 的优点为
$\mathrm{FeOOH}$可循环利用
,过程 2 中化合价发生变化的元素为
$\mathrm{S}$、$\mathrm{O}$
(填元素符号)。
探究三:碳酸亚铁应用非常广泛,可以做补血剂、阻燃剂、催化剂,还可用于皮革生产
(4) 碳酸亚铁在空气中受热发生的反应为$ 4FeCO₃+O₂\xrightarrow{\triangle}2Fe₂O₃+4CO₂,$它可以做阻燃剂的原因为
反应消耗氧气,生成二氧化碳,使可燃物与氧气隔绝
。
(5) FeCO₃的制备。
某兴趣小组同学利用如下图所示装置,通过 FeSO₄与 NH₄HCO₃反应制取 FeCO₃。
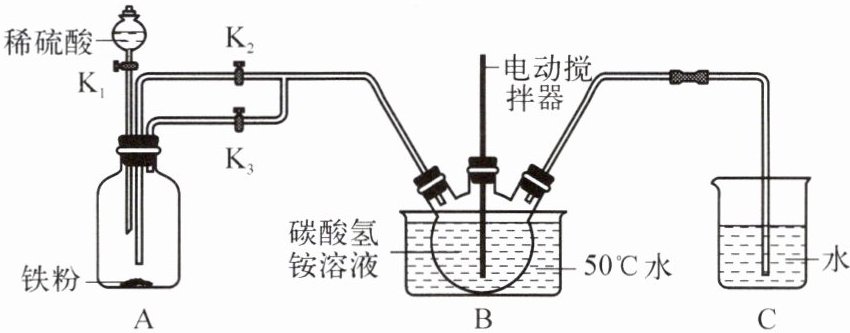
实验步骤如下:
a. 检查装置气密性,添加药品,并将导管末端插入装置 C 中水面以下;
b. 装置 A 中打开 K₁、K₃,关闭 K₂,制取硫酸亚铁,并将整个装置内的空气排尽;
c. 操作开关,将装置 A 中溶液导入装置 B 中产生 FeCO₃沉淀;
d. 将装置 B 中的混合物分离提纯,获得纯净的碳酸亚铁产品。
步骤 c 中应打开开关
$\mathrm{K_2}$
(填“K₁”“K₂”或“K₃”),并关闭其他开关,反应过程中控制装置 B 的温度在 50℃左右,原因是
防止碳酸氢铵受热分解
。
(6) FeCO₃的含量测定。
兴趣小组同学为确定某样品中 FeCO₃的含量,称取 20.0g 固体做如下图所示的实验。(已知其他杂质与稀硫酸不产生气体;碱石灰是 CaO 和 NaOH 的混合物)
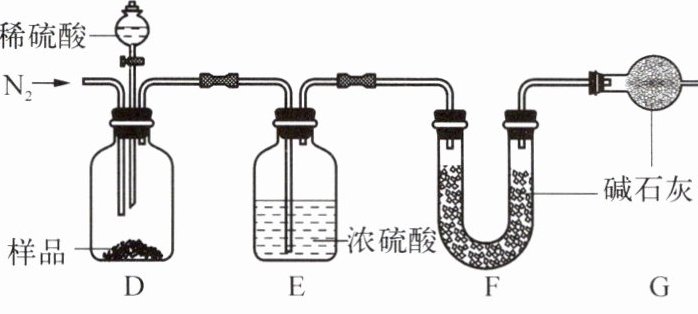
① 反应结束后,缓缓通一段时间 N₂的目的是
使生成的二氧化碳被F中的碱石灰充分吸收
。
② 实验后,测得装置 F 增重 0.88g,则 20.0g 固体中 FeCO₃的质量分数为
11.6%
。
③ 如果去掉装置 G,会使实验结果
偏大
(填“偏大”“偏小”或“不变”)。