19. (5 分)黑火药是我国古代的四大发明之一,其成分含有 KNO₃。古代以硝土和草木灰(主要成分 K₂CO₃)为原料生产 KNO₃的部分流程如图 1 所示。
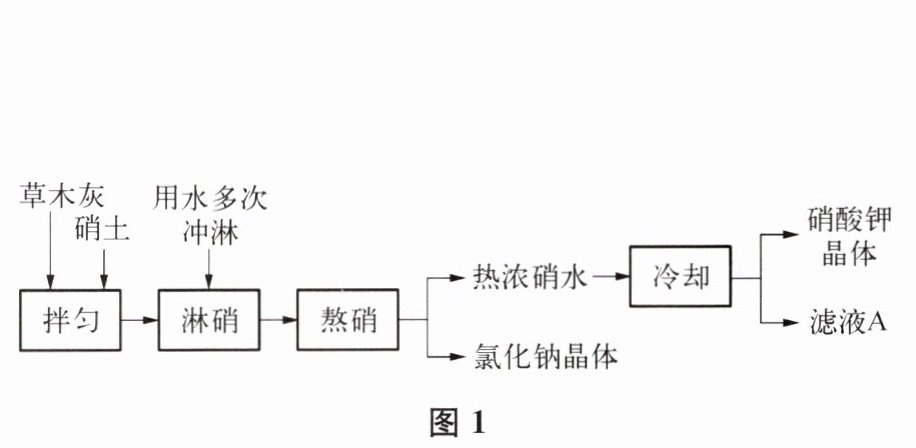
【查阅资料】① 硝土的主要成分是 KNO₃、Ca(NO₃)₂和 NaCl 等。
② Ca(NO₃)₂与 K₂CO₃能发生复分解反应。
(1) 淋硝所得的溶液称为“硝水”,其溶质中一定含有的物质是
$\mathrm{KNO_3}$、$\mathrm{NaCl}$
。
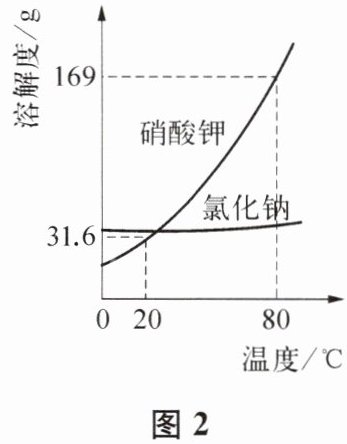
(2) 熬硝主要是将淋硝过程中得到的硝水浓缩成浓硝水。根据图 2 中的溶解度曲线分析,冷却热浓硝水,主要获得 KNO₃晶体的原因是
硝酸钾的溶解度随温度降低变化大,氯化钠溶解度随温度变化小,冷却热浓溶液时,硝酸钾溶解度大幅减小,易结晶析出
。若将 80℃的 269g 硝酸钾饱和溶液降温到 20℃,则析出硝酸钾晶体质量是
137.4
g。
(3) 滤液 A 可以循环使用,原因是
滤液A是$\mathrm{KNO_3}$的饱和溶液,能够提高原料的利用率,减少资源浪费
。
(4) 黑火药爆炸时发生反应的化学方程式是$ 2KNO₃+S+3C\xrightarrow{点燃}K₂S+X↑+3CO₂↑,$则 X 的化学式是
$\mathrm{N_2}$
。