问题1. 如何认识金属与酸溶液的反应?
要点 在镁、锌、铁、铜四种金属中,
镁、锌、铁
能与稀盐酸、稀硫酸发生反应,属于
活泼
金属;
铜
不能与稀盐酸、稀硫酸发生反应,属于
不活泼
金属。
应用 小林同学对A、B两种金属的活动性进行探究,他分别将A、B两种金属放入两支盛有相同溶质质量分数的稀盐酸的试管中,记录的实验现象为:A的表面产生气泡,B放入稀盐酸中无明显现象。根据小林同学的记录,你对A、B两种金属的活动性强弱作出的判断是
A>B
。
答案:问题1.要点:镁、锌、铁 活泼 铜 不活泼
应用:A>B
问题2. 如何认识置换反应?
要点 1. 置换反应与化合反应不同的是
置换反应生成物为两种,化合反应生成物为一种(答案合理即可)
。
2. 置换反应与分解反应不同的是
置换反应反应物为两种,分解反应反应物为一种(答案合理即可)
。
应用 为适应火车提速,需将原有的短轨连接为超长轨。工人常用$2Al+Fe₂O₃\xlongequal{高温}Al₂O₃+2Fe$这一反应原理来焊接钢轨。下列有关该反应的说法中,正确的是(
C
)
A. 该反应属于化合反应
B. 该反应属于分解反应
C. 该反应属于置换反应
D. 该反应中铁元素的化合价升高
答案:问题2.要点:1.置换反应生成物为两种,化合反应生成物为一种(答案合理即可) 2.置换反应反应物为两种,分解反应反应物为一种(答案合理即可) 应用:C
1. 手机的某些部件里含有Mg、Al、Cu、Ag等金属,若将废旧手机的部件粉碎并浸入足量稀硫酸中充分反应,则所得溶液中含有的金属离子是(
A
)
A.Mg²⁺、Al³⁺
B.Cu²⁺、Ag⁺
C.Al³⁺、Cu²⁺
D.Mg²⁺、Ag⁺
答案:1.A
解析:
在金属活动性顺序中,Mg、Al位于氢前,能与稀硫酸反应生成Mg²⁺、Al³⁺;Cu、Ag位于氢后,不与稀硫酸反应。所得溶液中含有的金属离子是Mg²⁺、Al³⁺。
A
2. 将质量相等的Mg、Al、Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是(
C
)
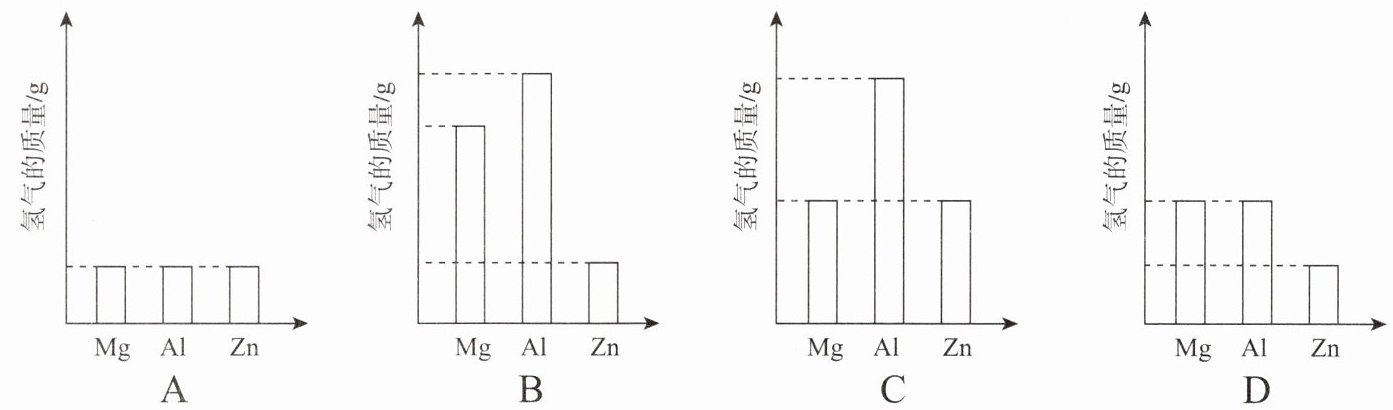
答案:2.C
解析:
解:
1. 金属过量时,生成氢气质量由硫酸决定,三者生成氢气质量相等,对应图A。
2. 硫酸过量时,生成氢气质量:$Al > Mg > Zn$,对应图B。
3. 部分金属反应完时,可能出现$Al = Mg > Zn$或$Al > Mg = Zn$,对应图D。
4. 图C中$Mg = Zn > Al$不符合上述任何情况。
结论:生成氢气的质量关系不可能的是C。
3. 铁是应用最广泛的金属。
(1) 写出铁丝在氧气中燃烧的化学方程式:
$3Fe+2O₂\overset{点燃}{=}Fe₃O₄$
。
(2) 新型材料纳米级铁粉能用作高效催化剂。实验室采用还原法制备纳米级铁粉,其流程如图所示:
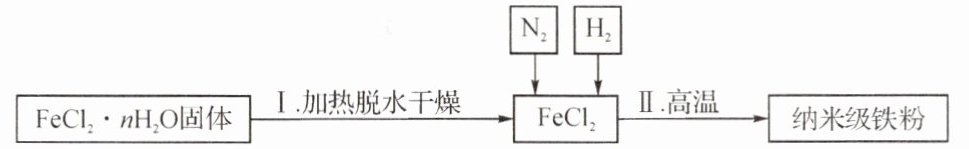
① 纳米级铁粉在空气中易自燃,生成黑色固体。实验中通入N₂的目的是
防止生成的纳米级铁粉被氧化
。
② 写出Ⅱ中H₂还原FeCl₂置换出铁的化学方程式:
$H₂+FeCl₂\overset{高温}{=}Fe+2HCl$
。
答案:$3.(1)3Fe+2O₂\overset{点燃}{=}Fe₃O₄$
(2)①防止生成的纳米级铁粉被氧化
$②H₂+FeCl₂\overset{高温}{=}Fe+2HCl$