3. 下表所示是$ NaCl $、$ KNO_3 $在不同温度时的溶解度:

下列说法错误的是(
B
)
A.$ KNO_3 $和$ NaCl $的溶解度相等的温度范围在$ 20\ ℃ \sim 30\ ℃ $
B.在$ 20\ ℃ $时,$ NaCl $和$ KNO_3 $固体各$ 34\ g $分别加入两只各盛有$ 100\ g $水的烧杯中,均不能形成饱和溶液
C.在$ 60\ ℃ $时,$ KNO_3 $的饱和溶液$ 105\ g $中含有溶质的质量为$ 55\ g $
D.从含有少量$ NaCl $的$ KNO_3 $饱和溶液中得到较多的$ KNO_3 $晶体,通常可采用冷却热饱和溶液的方法
答案:3. B
解析:
解:A. 20℃时,NaCl溶解度36.0g,KNO₃溶解度31.6g;30℃时,NaCl溶解度36.3g,KNO₃溶解度45.8g,故溶解度相等的温度范围在20℃~30℃,A正确。
B. 20℃时,NaCl溶解度36.0g,34g NaCl加入100g水形成不饱和溶液;KNO₃溶解度31.6g,34g KNO₃加入100g水形成饱和溶液,B错误。
C. 60℃时,KNO₃溶解度110g,设105g饱和溶液中溶质质量为x,$\frac{x}{105g}=\frac{110g}{100g+110g}$,解得x=55g,C正确。
D. KNO₃溶解度受温度影响大,NaCl受温度影响小,冷却热饱和溶液可得到较多KNO₃晶体,D正确。
答案:B
4. 下表所示是氯化钠和硝酸钾在不同温度时的溶解度:
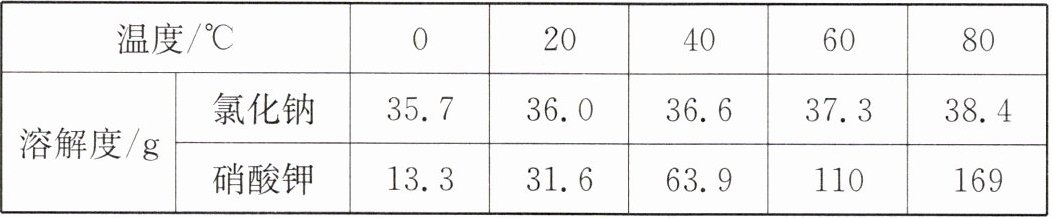
(1)从表中数据可以看出氯化钠和硝酸钾的溶解度随温度升高而
增大
(填“增大”或“减小”)。
(2)$ 20\ ℃ $时,把$ 50\ g $氯化钠放入$ 100\ g $水中,充分溶解后,所得溶液质量为
136.0
$ g $。
(3)若硝酸钾饱和溶液中有少量的氯化钠,可用
③
(填序号)法提纯硝酸钾。
①趁热过滤 ②蒸发结晶 ③冷却热饱和溶液
答案:4. (1)增大 (2)136.0 (3)③
5. 从盐卤水(含硫酸钠、氯化钠等)中提取的硫酸钠可用于制中药西瓜霜,硫酸钠和氯化钠的溶解度曲线如图所示。下列说法正确的是(
C
)
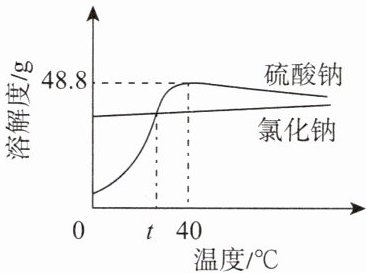
A.$ 40\ ℃ $时,氯化钠的溶解度是$ 48.8\ g $
B.$ t\ ℃ $时,氯化钠溶液和硫酸钠溶液的溶质质量相等
C.可用降温结晶的方法从盐卤水中提取硫酸钠晶体
D.将$ t\ ℃ $饱和硫酸钠溶液变为不饱和溶液的方法是加溶剂或降低温度
答案:5. C
6. 某同学测得 B 物质的溶解度如表所示:
(1)根据表中测出的溶解度数据,在图甲中画出 B 物质的溶解度曲线图。
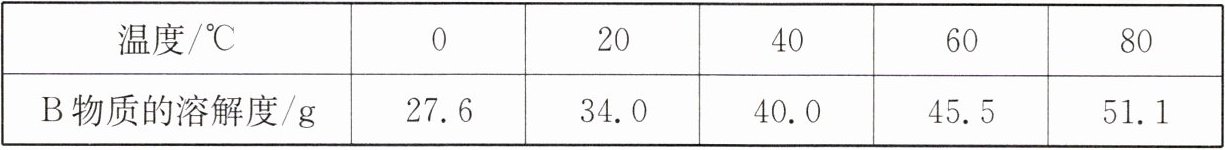
(2)根据图甲可知,$ T = $
10
$ ℃ $时,C 物质的溶解度等于 A 物质的溶解度。
(3)要使接近饱和的 A、B、C 三种溶液都变为饱和溶液,可采用的相同方法是
加入溶质
(任填一种)。
(4)如图乙所示,常温下分别向装有适量 A、C 物质的两支试管里加入等量蒸馏水,充分振荡后,两支试管底部均有未溶解的固体。再将两支试管放入盛有冰水混合物的烧杯中,看到的实验现象是:装 C 物质的试管中固体增多,装 A 物质的试管中固体减少。请你对此现象做出解释:
温度降低,C的溶解度减小,溶液中析出晶体,A的溶解度增大,A继续溶解。
。

答案:6. (1)B物质的溶解度曲线图如图所示:

(2)10 (3)加入溶质 (4)温度降低,C的溶解度减小,溶液中析出晶体,A的溶解度增大,A继续溶解。