1. 溶液组成的定量表示——溶质质量分数
(1)定义:溶质质量分数是
溶质与溶液的质量
之比;其计算公式为溶质质量分数=
$\frac{\text{溶质的质量}}{\text{溶液的质量}} × 100\%$
。
(2)含义:若某溶液中溶质质量分数为a%,它表示每100份质量的该溶液中含有
$a$
份质量的溶质,此溶液中m(溶质):m(溶剂):m(溶液)=
$a:$ $(100 - a):100$
。
(3)稀释计算:溶液在稀释过程中
溶质
的质量保持不变。稀释公式为浓溶液的质量×浓溶液中溶质质量分数=
稀溶液的质量 $×$ 稀溶液中溶质质量分数
;稀释所加水的质量=
稀溶液的质量 $-$ 浓溶液的质量
。
答案:(1) 溶质与溶液的质量 $\frac{\text{溶质的质量}}{\text{溶液的质量}} × 100\%$ (2) $a$ $a:$ $(100 - a):100$ (3) 溶质 稀溶液的质量 $×$ 稀溶液中溶质质量分数 稀溶液的质量 $-$ 浓溶液的质量
2. 配制一定溶质质量分数的溶液
(1)实验步骤为
计算
、
称量(或量取)
、
溶解(或稀释)
、装瓶存放。
(2)所需仪器有
托盘天平(或电子秤)
、
烧杯
、
量筒
、
玻璃棒
、
药匙
、
胶头滴管
等。
(3)导致所配制的溶液溶质质量分数偏低的原因可能有
仰视读取水的体积
、
烧杯内壁有水(或试剂不纯等合理答案均可)
等。导致所配制的溶液溶质质量分数偏高的原因可能有
俯视读取水的体积
、
将水倒入烧杯时,有水洒出(合理答案均可)
等。
答案:(1) 计算 称量(或量取) 溶解(或稀释) (2) 托盘天平(或电子秤) 烧杯 量筒 玻璃棒 药匙 胶头滴管 (3) 仰视读取水的体积 烧杯内壁有水(或试剂不纯等合理答案均可) 俯视读取水的体积 将水倒入烧杯时,有水洒出(合理答案均可)
1. (2025·宿迁段考)一种抗生素为粉末状固体,每瓶含0.5g,注射时应配成溶质质量分数为20%的溶液,则使用时每瓶需加入蒸馏水 (
B
)
A.1mL
B.2mL
C.3mL
D.4mL
答案:B
解析:
解:设配成20%溶液的质量为x。
溶质质量分数 = 溶质质量 / 溶液质量 × 100%
20% = 0.5g / x × 100%
x = 0.5g / 20% = 2.5g
溶剂质量 = 溶液质量 - 溶质质量 = 2.5g - 0.5g = 2g
水的密度为1g/mL,所以蒸馏水体积 = 2g / 1g/mL = 2mL
答案:B
2. 如图所示为实验室配制NaCl溶液的操作示意图。请回答下列问题:
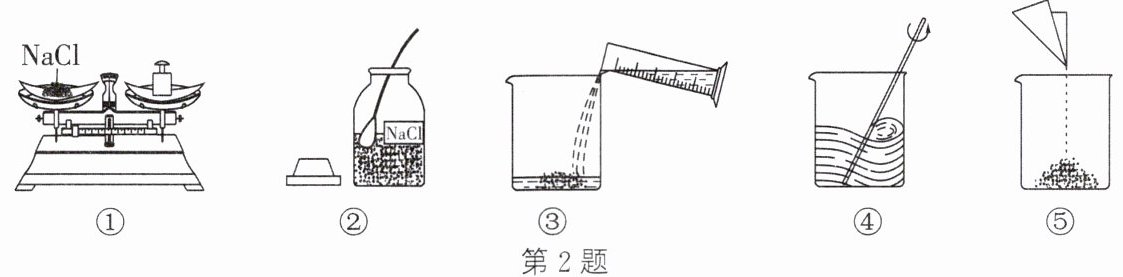
(1)图中用到的玻璃仪器有
烧杯
、量筒、玻璃棒、广口瓶。
(2)图中正确的操作顺序为
②①⑤③④
(填序号)。
(3)溶解时用玻璃棒搅拌的目的是
加快溶解速率
。
答案:(1) 烧杯 (2) ②①⑤③④ (3) 加快溶解速率
3. 10%的氯化钙溶液常用作路面的保湿剂。
(1)配制200kg10%的氯化钙溶液,需要氯化钙的质量为
20
kg,需要水的质量为
180
kg。
(2)现有100kg30%的氯化钙溶液,若要稀释成10%的氯化钙溶液,需要加入水的质量为
200
kg。
答案:(1) 20 180 (2) 200
解析:
(1)解:需要氯化钙的质量为$200\mathrm{kg}×10\% = 20\mathrm{kg}$,需要水的质量为$200\mathrm{kg}-20\mathrm{kg}=180\mathrm{kg}$。
(2)解:设需要加入水的质量为$x$,$100\mathrm{kg}×30\%=(100\mathrm{kg}+x)×10\%$,解得$x = 200\mathrm{kg}$。