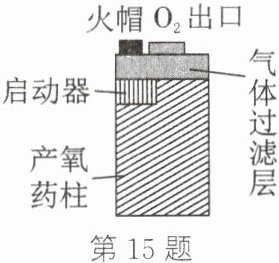
15. (5 分)氧烛是一种用于缺氧环境中自救的供氧源,主要成分为氯酸钠(NaClO₃),还含有适量的催化剂、成型剂、金属粉等。某品牌的氧烛结构如图所示,氧烛通过撞击火帽引发反应后,能持续放出高纯氧气,其主要反应为$ 2NaClO₃\xlongequal[\triangle ]{催化剂}2NaCl+3O₂↑。$
(1)根据氧烛反应原理分析,撞击火帽的目的是点燃内部金属粉末,为制取氧气的反应提供所需的
热量(或能量)
。
(2)NaClO₃ 中氯元素的化合价为
+5
。
(3)该品牌氧烛中含 NaClO₃ 10.65kg,反应后 NaClO₃ 中氧元素全部转化为氧气,则理论上可生成氧气的质量为多少千克? (写出计算过程)
解:设理论上生成氧气的质量为 x。
$2NaCl{O}_{3}\xlongequal[\triangle ]{催化剂}2NaCl+3{O}_{2}\uparrow$
$\frac {213}{96}=\frac {10.65kg}{x}$
$x=4.8kg$
答:理论上可生成氧气的质量为 4.8 kg。
答案:(1) 热量(或能量) (2) +5 (3) 解:设理论上生成氧气的质量为 x。
$2NaCl{O}_{3}\xlongequal[\triangle ]{催化剂}2NaCl+3{O}_{2}\uparrow$
$\frac {213}{96}=\frac {10.65kg}{x}$
$x=4.8kg$
答:理论上可生成氧气的质量为 4.8 kg。
16. (6 分)某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取 30g 该溶液,向其中逐滴加入溶质质量分数为 10%的氢氧化钠(NaOH)溶液,生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示。反应的化学方程式为$ MgSO₄+2NaOH\xlongequal{\;}Na₂SO₄+Mg(OH)₂↓。$
(1)配制 100g 溶质质量分数为 10%的 NaOH 溶液,需 NaOH 的质量为______
10
g。
(2)计算该 MgSO₄ 溶液中溶质的质量分数。

解:设 30 g$MgSO_{4}$溶液中溶质的质量为 x。
$MgS{O}_{4}+2NaOH=N{a}_{2}S{O}_{4}+Mg(OH)_{2}\downarrow$
$\frac {120}{58}=\frac {x}{2.9g}$
$x=6g$
该$MgSO_{4}$溶液中溶质的质量分数为$\frac{6g}{30g}× 100\%=20\%$。
答:该$MgSO_{4}$溶液中溶质的质量分数为 20%。
答案:(1) 10 (2) 解:设 30 g$MgSO_{4}$溶液中溶质的质量为 x。
$MgS{O}_{4}+2NaOH=N{a}_{2}S{O}_{4}+Mg(OH)_{2}\downarrow$
$\frac {120}{58}=\frac {x}{2.9g}$
$x=6g$
该$MgSO_{4}$溶液中溶质的质量分数为$\frac{6g}{30g}× 100\%=20\%$。
答:该$MgSO_{4}$溶液中溶质的质量分数为 20%。