8. 空气质量监测仪是根据二氧化硫与溴水的反应来定量测定空气中的二氧化硫含量, 其主要原理为${SO_{2} + Br_{2} + 2H_{2}O\xlongequal{\;\;}2HBr + H_{2}SO_{4}}$, 假设向含有 16 mg ${Br_{2}}的溴水中缓慢通入某工业废气20m^{3}$时恰好完全反应。
(1) 计算$20m^{3}该工业废气中所含{SO_{2}}$的质量(写出计算过程)。
解: 设 $20\mathrm{m}^{3}$ 该工业废气中所含 $\mathrm{SO}_{2}$ 的质量为 x。
$\begin{aligned}\mathrm{SO}_{2}+\mathrm{Br}_{2}+2\mathrm{H}_{2}\mathrm{O}&=2\mathrm{HBr}+\mathrm{H}_{2}\mathrm{SO}_{4}\\64&160\\x&16\mathrm{mg}\frac{64}{160}&=\frac{x}{16\mathrm{mg}}\\x&=6.4\mathrm{mg}\end{aligned}$
答: $20\mathrm{m}^{3}$ 该工业废气中所含 $\mathrm{SO}_{2}$ 的质量为 6.4 mg。
(2) 某地区规定工业排放的废气中${SO_{2}}含量不得超过0.4mg/m^{3}$, 则该工业废气______
符合
(填“符合”或“不符合”)排放标准。
答案:(1) 解: 设 $20\mathrm{m}^{3}$ 该工业废气中所含 $\mathrm{SO}_{2}$ 的质量为 x。
$\begin{aligned}\mathrm{SO}_{2}+\mathrm{Br}_{2}+2\mathrm{H}_{2}\mathrm{O}&=2\mathrm{HBr}+\mathrm{H}_{2}\mathrm{SO}_{4}\\64&160\\x&16\mathrm{mg}\\frac{64}{160}&=\frac{x}{16\mathrm{mg}}\\x&=6.4\mathrm{mg}\end{aligned}$
答: $20\mathrm{m}^{3}$ 该工业废气中所含 $\mathrm{SO}_{2}$ 的质量为 6.4 mg。
(2) 符合 解析: (2) 某地区规定工业排放的废气中 $\mathrm{SO}_{2}$ 含量不得超过 $0.4\mathrm{mg}/\mathrm{m}^{3}$, 该工业废气中二氧化硫含量为 $\frac{6.4\mathrm{mg}}{20\mathrm{m}^{3}}=0.32\mathrm{mg}/\mathrm{m}^{3}<0.4\mathrm{mg}/\mathrm{m}^{3}$, 故该工业废气符合排放标准。
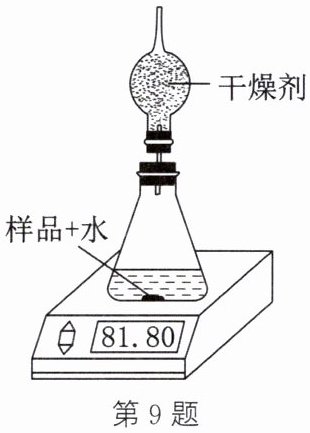
9. 小红同学利用过氧化钠能和水反应的原理来测定${Na_{2}O_{2}}$的纯度。已知:${2Na_{2}O_{2} + 2H_{2}O\xlongequal{\;\;}4NaOH + O_{2}\uparrow }$。
【实验步骤】① 称取 20 g 样品置于装置中(整个装置的质量为 45 g)。② 一次性加入 20 mL 蒸馏水后将装置放置在电子天平上, 观察显示数字的变化, 并记录(数据如表)。③ 进行计算。
|时间/s|60|120|180|240|300|
|天平示数/g|83.82|82.43|82.15|81.80|81.80|
(1) 如果没有干燥剂, 测定结果会______(填“偏大”“偏小”或“不变”)。
(2) 请你帮小红同学计算此样品中${Na_{2}O_{2}}$的质量分数。
(1)
偏大
(2)
解: 根据质量守恒定律,化学反应前后物质的总质量不变, $20\mathrm{mL}$ 蒸馏水的质量为 20 g, 则生成氧气的质量为 $20\mathrm{g}+45\mathrm{g}+20\mathrm{g}-81.80\mathrm{g}=3.2\mathrm{g}$; 设 20 g 该样品中过氧化钠的质量为 x。
$\begin{aligned}2\mathrm{Na}_{2}\mathrm{O}_{2}+2\mathrm{H}_{2}\mathrm{O}&=4\mathrm{NaOH}+\mathrm{O}_{2}\uparrow\\156&32\\x&3.2\mathrm{g}\frac{156}{32}&=\frac{x}{3.2\mathrm{g}}\\x&=15.6\mathrm{g}\end{aligned}$
此样品中 $\mathrm{Na}_{2}\mathrm{O}_{2}$ 的质量分数为 $\frac{15.6\mathrm{g}}{20\mathrm{g}}×100\% = 78\%$。
答: 此样品中 $\mathrm{Na}_{2}\mathrm{O}_{2}$ 的质量分数为 $78\%$。
答案:(1) 偏大 (2) 解: 根据质量守恒定律,化学反应前后物质的总质量不变, $20\mathrm{mL}$ 蒸馏水的质量为 20 g, 则生成氧气的质量为 $20\mathrm{g}+45\mathrm{g}+20\mathrm{g}-81.80\mathrm{g}=3.2\mathrm{g}$; 设 20 g 该样品中过氧化钠的质量为 x。
$\begin{aligned}2\mathrm{Na}_{2}\mathrm{O}_{2}+2\mathrm{H}_{2}\mathrm{O}&=4\mathrm{NaOH}+\mathrm{O}_{2}\uparrow\\156&32\\x&3.2\mathrm{g}\\frac{156}{32}&=\frac{x}{3.2\mathrm{g}}\\x&=15.6\mathrm{g}\end{aligned}$
此样品中 $\mathrm{Na}_{2}\mathrm{O}_{2}$ 的质量分数为 $\frac{15.6\mathrm{g}}{20\mathrm{g}}×100\% = 78\%$。
答: 此样品中 $\mathrm{Na}_{2}\mathrm{O}_{2}$ 的质量分数为 $78\%$。
解析: (1) 如果没有干燥剂,水蒸气会和氧气一起逸出装置,导致测得的氧气质量偏大,则过氧化钠纯度的测定结果偏大。
10. (2023·滨州)实验室有一瓶标签被腐蚀的盐酸。某化学兴趣小组的同学为测定该盐酸的溶质质量分数, 取 50 g 此盐酸于烧杯中, 然后加入硝酸银溶液。加入硝酸银溶液的质量与生成沉淀的质量关系如图所示(已知:${HCl + AgNO_{3}\xlongequal{\;\;}AgCl\downarrow + HNO_{3}}$)。试计算:
(1) 两种物质恰好完全反应时, 所得溶液的质量是______g。
(2) 该盐酸的溶质质量分数。

(1)
81.3
(2)解: 设 50 g 该盐酸中溶质的质量为 x。
$\begin{aligned}\mathrm{HCl}+\mathrm{AgNO}_{3}&=\mathrm{AgCl}\downarrow+\mathrm{HNO}_{3}\\36.5&143.5\\x&28.7\mathrm{g}\frac{36.5}{143.5}&=\frac{x}{28.7\mathrm{g}}\\x&=7.3\mathrm{g}\end{aligned}$
该盐酸的溶质质量分数为 $\frac{7.3\mathrm{g}}{50\mathrm{g}}×100\% = 14.6\%$。
答: 该盐酸的溶质质量分数为 $14.6\%$。
答案:(1) 81.3 (2) 解: 设 50 g 该盐酸中溶质的质量为 x。
$\begin{aligned}\mathrm{HCl}+\mathrm{AgNO}_{3}&=\mathrm{AgCl}\downarrow+\mathrm{HNO}_{3}\\36.5&143.5\\x&28.7\mathrm{g}\\frac{36.5}{143.5}&=\frac{x}{28.7\mathrm{g}}\\x&=7.3\mathrm{g}\end{aligned}$
该盐酸的溶质质量分数为 $\frac{7.3\mathrm{g}}{50\mathrm{g}}×100\% = 14.6\%$。
答: 该盐酸的溶质质量分数为 $14.6\%$。
解析: (1) 由图可知,两种物质恰好完全反应时,消耗 60 g 硝酸银溶液,产生 28.7 g 氯化银沉淀,则所得溶液的质量为 $50\mathrm{g}+60\mathrm{g}-28.7\mathrm{g}=81.3\mathrm{g}$。