6. 过碳酸钠$(2Na_{2}CO_{3}\cdot 3H_{2}O_{2})$常用于洗涤合成纤维、动物纤维、合成树脂纤维等材质的衣物,不损伤面料,不泛黄。某兴趣小组的同学在过碳酸钠中加入稀盐酸,产生许多气泡。该小组的同学对此产生了浓厚的兴趣,进行了如下探究。
【查阅资料】① 点燃条件下,镁能与二氧化碳反应生成氧化镁与碳;② 足量的氢氧化钠溶液能除尽二氧化碳,不能吸收氧气。
探究一:过碳酸钠与稀盐酸反应产生的气体成分。
【猜想假设】小华认为该气体中可能含有$O_{2}$、$N_{2}$、$CO_{2}$;小明认为该气体中不可能含有$N_{2}$,因为
反应物中不含氮元素(或根据质量守恒定律可知,化学反应前后元素的种类不变等合理答案均可)
;该小组的其他同学认为该气体中可能含有$CO_{2}$、$O_{2}$中的一种或两种。
【进行实验】实验操作及实现现象如表所示。
|实验编号|实验操作|实验现象|
|①|将气体通入澄清石灰水中|澄清石灰水变浑浊|
|②|将气体通过灼热的铜网|铜网表面变黑|
【实验分析】
(1) 由实验①可知,该气体中含有$CO_{2}$;实验①中反应的化学方程式是
$ CO_2 + Ca(OH)_2 = CaCO_3 \downarrow + H_2O $
。
(2) 由实验②可知,该气体中含有
$ O_2 $
。
【继续探究】请利用$CO_{2}的化学性质再设计一个实验证明该气体中含有CO_{2}$:
将气体通入紫色石蕊试液中,紫色石蕊变红(合理答案均可)
。
探究二:测定产生的气体中氧气的体积分数。
方法 1:某同学提出可以用如图甲所示装置测定气体中氧气的含量。
小组的同学分析后一致认为不可行,原因是
在点燃的条件下,镁与氧气、二氧化碳都能发生反应
。
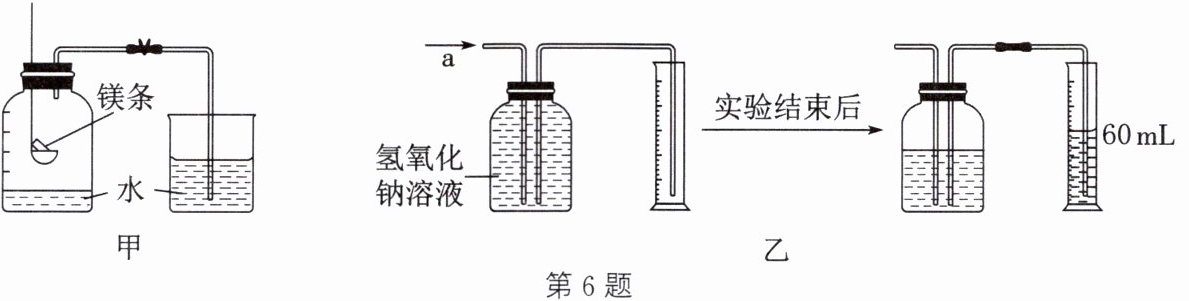
方法 2:用如图乙所示的装置测量气体中氧气的含量。
(1) 抽取 140 mL 该气体,缓缓地从 a 处通入装置中。
(2) 实验结束后,收集到氧气的体积为
60
mL。
(3) 测得氧气与二氧化碳的体积比为
$ 3:4 $
(填最简整数比)。
【拓展延伸】
(1) 方法 2 中,气体缓缓通入氢氧化钠溶液的目的是
使二氧化碳与氢氧化钠充分反应
。
(2) 过碳酸钠在热水中比在冷水中产生气泡的速率快,原因是
温度越高,反应速率越快
。