7. 根据如图所示实验回答问题(已知:稀盐酸与氯化钠溶液不反应)。
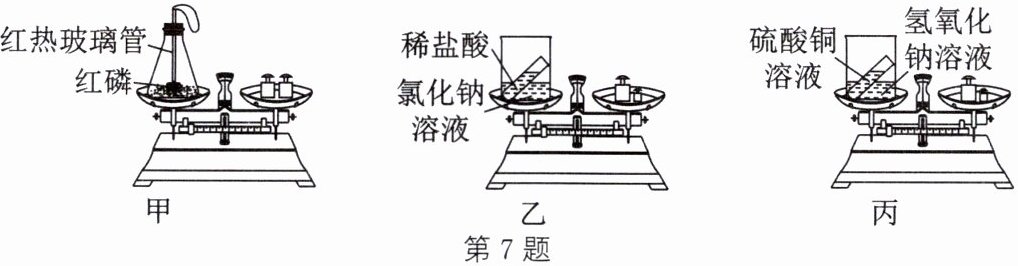
(1) 实验甲中,能验证质量守恒定律的现象是
反应前和装置冷却后天平保持平衡
。
(2) 实验乙中,同学们观察到反应后天平平衡,但小柯同学认为该实验不能直接用于验证质量守恒定律,理由是
稀盐酸与氯化钠溶液不反应
,用其他试剂替换氯化钠溶液,则该试剂应具备的条件是
与稀盐酸反应但不产生气体,且反应现象明显
。
(3) 实验丙中,观察到
有蓝色沉淀生成
的现象时说明反应发生,可以观察天平是否平衡。
(4) 实验甲中,气球膨胀后又变瘪,天平指针随着向右偏转后又恢复平衡,指针向右偏转的原因是
红磷燃烧放出大量的热,使瓶内气体膨胀,气球浮力增大,导致天平指针向右偏转
。
答案:(1) 反应前和装置冷却后天平保持平衡
(2) 稀盐酸与氯化钠溶液不反应 与稀盐酸反应但不产生气体,且反应现象明显
(3) 有蓝色沉淀生成
(4) 红磷燃烧放出大量的热,使瓶内气体膨胀,气球浮力增大,导致天平指针向右偏转
8. (2024·扬州宝应期末)实验室用氯酸钾和二氧化锰(固体总质量为m)制取氧气,加热一段时间后固体混合物剩余10g,继续加热至完全反应后固体还剩9.04g,再将固体加水充分溶解、过滤、干燥后得到1.59g固体。下列说法不正确的是 (
A
)
A.最终生成氧气的总质量为0.96g
B.$m = 13.84g$
C.最终生成氯化钾质量为7.45g
D.过程中二氧化锰的质量和化学性质都不变
答案:A
解析:10g 为加热一段时间后的质量,故最终生成氧气的总质量肯定大于 $ 10g - 9.04g = 0.96g $,A 不正确。二氧化锰为该反应的催化剂,反应前后质量不变,且二氧化锰难溶于水,氯化钾可溶于水,则最终得到的固体质量即为二氧化锰的质量,即二氧化锰的质量为 1.59g,生成的氯化钾的质量为 $ 9.04g - 1.59g = 7.45g $,设参与反应的氯酸钾的质量为 x。$\begin{aligned}2KClO_3 &\xlongequal[\triangle]{MnO_2} 2KCl + 3O_2 \uparrow\\245 &\quad 149\\x &\quad 7.45g\end{aligned}$
$\frac{245}{149} = \frac{x}{7.45g} \quad x = 12.25g$
则开始时固体总质量为 $ 12.25g + 1.59g = 13.84g $,B 正确。由以上分析可知,最终生成氯化钾的质量为 7.45g,C 正确。二氧化锰为催化剂,反应前后质量和化学性质都不变,D 正确。故本题选 A。
9. “化学氧自救呼吸器”是人在缺氧环境或出现高浓度有毒有害气体环境中使用的一种安全防护装置。制氧剂的主要成分是超氧化钾($KO_{2}$),反应原理为$4KO_{2}+mCO_{2}= mK_{2}CO_{3}+3O_{2}$。计算:
(1) m的值为______
2
。
(2) 同学们查阅资料得知人每小时约呼出二氧化碳44g,若“化学氧自救呼吸器”中$KO_{2}$的质量为142g,则理论上该“化学氧自救呼吸器”可使用______
1
h。
(3) 若要制得96g氧气,理论上需要含超氧化钾80%的制氧剂的质量。
解:设理论上需要含超氧化钾 80%的制氧剂的质量为 y。
$\begin{aligned}4KO_2 + 2CO_2 &= 2K_2CO_3 + 3O_2\\284 &\quad 96\\y × 80\% &\quad 96g\end{aligned}$
$\frac{284}{96} = \frac{y × 80\%}{96g} \quad y = 355g$
答:若要制得 96g 氧气,理论上需要含超氧化钾 80%的制氧剂的质量为 355g。
答案:(1) 2
(2) 1
(3) 解:设理论上需要含超氧化钾 80%的制氧剂的质量为 y。
$\begin{aligned}4KO_2 + 2CO_2 &= 2K_2CO_3 + 3O_2\\284 &\quad 96\\y × 80\% &\quad 96g\end{aligned}$
$\frac{284}{96} = \frac{y × 80\%}{96g} \quad y = 355g$
答:若要制得 96g 氧气,理论上需要含超氧化钾 80%的制氧剂的质量为 355g。
解析:(1) 由质量守恒定律可知,化学反应前后原子的种类和数目不变,由钾原子的数目可推出 m 的值为 2。
(2) 设 142g $ KO_2 $ 消耗二氧化碳的质量为 x。
$\begin{aligned}4KO_2 + 2CO_2 &= 2K_2CO_3 + 3O_2\\284 &\quad 88\\142g &\quad x\end{aligned}$
$\frac{284}{88} = \frac{142g}{x} \quad x = 44g$
由“同学们查阅资料得知人每小时约呼出二氧化碳 44g”可知,若“化学氧自救呼吸器”中 $ KO_2 $ 的质量为 142g,则理论上该“化学氧自救呼吸器”可使用 1h。
10. (2024·眉山)实验室有一瓶标签被腐蚀的$Na_{2}SO_{4}$溶液。某化学兴趣小组的同学为测定该$Na_{2}SO_{4}$溶液的溶质质量分数,取100g$Na_{2}SO_{4}$溶液于烧杯中,然后加入$BaCl_{2}$溶液,生成沉淀的质量与加入$BaCl_{2}$溶液的质量关系如图所示(已知:$BaCl_{2}+Na_{2}SO_{4}= BaSO_{4}\downarrow +2NaCl$)。
(1) 两种物质恰好完全反应时,生成沉淀的质量是______g。
(2) 求该$Na_{2}SO_{4}$溶液的溶质质量分数。(写出计算过程)

(1)
2.33
(2)
解:设该 $ Na_2SO_4 $ 溶液中溶质的质量为 x。
$\begin{aligned}BaCl_2 + Na_2SO_4 &= BaSO_4 \downarrow + 2NaCl\\142 &\quad 233\\x &\quad 2.33g\end{aligned}$
$\frac{142}{233} = \frac{x}{2.33g} \quad x = 1.42g$
该 $ Na_2SO_4 $ 溶液的溶质质量分数为 $ \frac{1.42g}{100g} × 100\% = 1.42\% $。
答:该 $ Na_2SO_4 $ 溶液的溶质质量分数为 1.42%。
答案:(1) 2.33
(2) 解:设该 $ Na_2SO_4 $ 溶液中溶质的质量为 x。
$\begin{aligned}BaCl_2 + Na_2SO_4 &= BaSO_4 \downarrow + 2NaCl\\142 &\quad 233\\x &\quad 2.33g\end{aligned}$
$\frac{142}{233} = \frac{x}{2.33g} \quad x = 1.42g$
该 $ Na_2SO_4 $ 溶液的溶质质量分数为 $ \frac{1.42g}{100g} × 100\% = 1.42\% $。
答:该 $ Na_2SO_4 $ 溶液的溶质质量分数为 1.42%。