4. 实验室中欲制备一种气体,已知该气体的密度比空气小,难溶于水且有剧毒,则收集该气体最适宜的方法是 (
B
)
A.向上排空气法
B.排水集气法
C.向下排空气法
D.向下排空气法和排水集气法
答案:B
解析:
该气体密度比空气小,理论上可采用向下排空气法收集,但因其有剧毒,排空气法收集会导致气体泄漏,存在安全隐患;该气体难溶于水,可用排水集气法收集,排水法能有效防止气体泄漏。故最适宜的收集方法是排水集气法。
B
5. 下列是“要完成的实验——仪器和用品的选择”组合。根据图示分析,组合不合理的是 (
C
)
A.收集$CO_{2}$气体——⑥⑦⑧
B.检验$CO_{2}$是否收集满——⑥⑦⑧⑨
C.用$H_{2}O_{2}溶液和MnO_{2}制取O_{2}$的发生装置——①②
D.用大理石和稀盐酸制取$CO_{2}$的发生装置——③④⑤
答案:C 解析:二氧化碳能溶于水,密度比空气大,因此用向上排空气法收集,可选⑥⑦⑧,A 正确;二氧化碳的验满方法是将一根燃着的木条放在集气瓶口,若木条熄灭,则证明已集满,仪器和用品组合可选⑥⑦⑧⑨,B 正确;用 ${H_{2}O_{2}}$ 溶液和 ${MnO_{2}}$ 制取 ${O_{2}}$ 需要的是固液常温型发生装置,可选③④⑤,C 错误;用大理石和稀盐酸在常温下反应制取 ${CO_{2}}$ 的发生装置可选③④⑤,D 正确。故本题选 C。
6. (2024·无锡惠山段考)学校兴趣小组同学利用如图Ⅰ、Ⅱ装置进行实验研究。
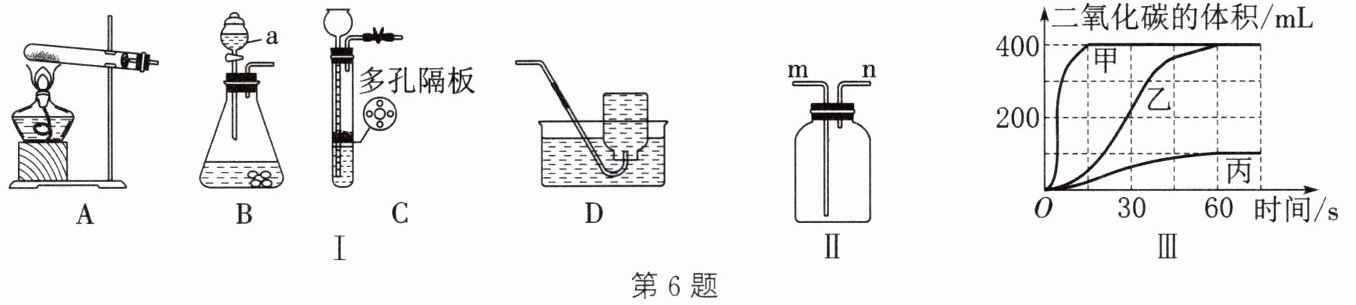
【活动一】研究氧气的制取。
(1)写出仪器a的名称:
分液漏斗
。
(2)实验室用高锰酸钾制取纯净的氧气选用的装置组合是
AD
(填字母),发生反应的化学方程式为
${2KMnO_{4}\xlongequal{\triangle}K_{2}MnO_{4} + MnO_{2} + O_{2}\uparrow }$
。若用图Ⅱ装置来收集,则验满的方法是
将带火星的木条伸到 n 端导管口,若木条复燃,则证明氧气已收集满
。
【活动二】研究二氧化碳的制取。
(3)按如表进行实验,取等质量的同种大理石加入足量酸中(杂质不与酸反应),产生二氧化碳的体积随时间变化的曲线如图Ⅲ所示。表中实验①对应图Ⅲ中的曲线
丙
(填“甲”“乙”或“丙”)。小组同学决定用实验②的试剂制取二氧化碳气体,不用实验③的试剂制取二氧化碳的原因是
粉末状大理石与稀盐酸接触面积大,反应速率太快
。
(4)兴趣小组同学利用25g鸡蛋壳(主要成分为碳酸钙)和足量稀盐酸制取二氧化碳时想要控制反应速率,应选择图Ⅰ中的
B
作为发生装置。若要检验生成的气体,则应选择的试剂是
澄清石灰水
(填试剂名称)。若实验过程中收集到8.8g气体,则该鸡蛋壳中碳酸钙的质量分数为
80%
。
答案:(1)分液漏斗 (2)AD ${2KMnO_{4}\xlongequal{\triangle}K_{2}MnO_{4} + MnO_{2} + O_{2}\uparrow }$ 将带火星的木条伸到 n 端导管口,若木条复燃,则证明氧气已收集满 (3)丙 粉末状大理石与稀盐酸接触面积大,反应速率太快 (4)B 澄清石灰水 80% 解析:(4)设该鸡蛋壳中碳酸钙的质量分数为 x。${CaCO_{3} + 2HCl\xlongequal{}CaCl_{2} + H_{2}O + CO_{2}\uparrow }$100 4425 g×x 8.8 g$\frac{100}{44}=\frac{25g× x}{8.8g}$ $x = 80\%$则该鸡蛋壳中碳酸钙的质量分数为 80%。